Struktur af primært optogenetisk værktøj afsløret
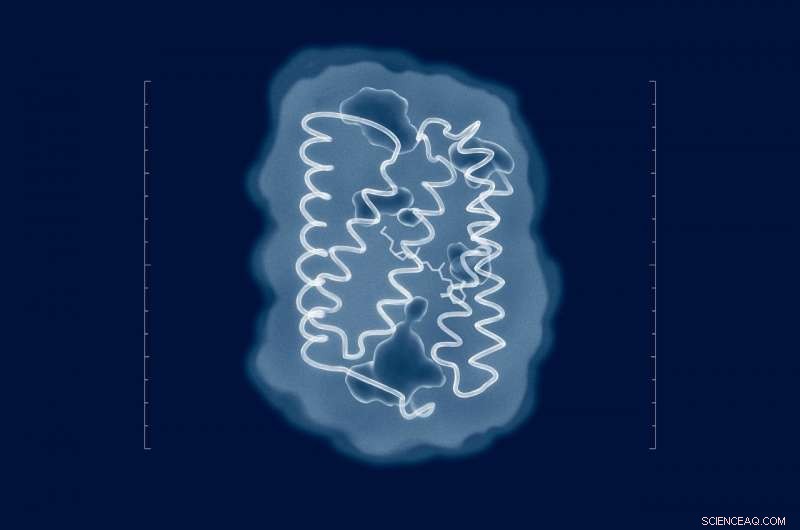
Forsøg på at løse strukturen af ChR2 går helt tilbage til tidspunktet for dets opdagelse i 2003. Men på trods af indsatsen fra adskillige forskningsgrupper fra hele verden, strukturen af proteinet i dets naturlige tilstand er forblevet ukendt. Nu hvor forskerne har strukturen, meningsfulde mutationer kan indføres i proteinet for at tilpasse dets egenskaber til kravene i et specifikt eksperiment. Kredit:MIPT
Et internationalt team af forskere har bestemt 3D-strukturen af kanalrhodopsin 2, et membranprotein, der er meget brugt i optogenetik til at kontrollere nerveceller med lys. Optogenetik er en relativt ny teknik, der involverer brugen af lys til at manipulere nerve- og muskelceller i en levende organisme. Lignende tilgange bruges til delvist at vende tabet af hørelse og syn og kontrollere muskelsammentrækninger.
Ud over, optogenetiks metoder bruges til at studere egenskaberne af naturlige neuronnetværk, som er ansvarlige for følelser, beslutningstagning, og andre komplekse processer i levende organismer. Optogenetik var Natur 'Årets metode 2010, " samt at være navngivet blandt Videnskab 's "Breakthroughs of 2010 and Insights of the Decade."
Channelrhodopsin 2, eller ChR2, er et vigtigt optogenetisk værktøj. Det er et lysfølsomt protein, der oprindeligt blev udvundet i 2003 fra en grønalge kaldet Chlamydomonas reinhardtii. Forskere kan indsætte ChR2 i membranen af en levende celle for at kontrollere den. Når den er oplyst, dette protein tillader positivt ladede ioner at passere ind i cellen gennem cellemembranen. I en nervecelle, dette depolariserer membranen, efterligner virkningen af en nerveimpuls og får netop denne neuron til at fyre.
Fordi ChR2 virker hurtigt og er relativt harmløs for celler, det er den nuværende løsning til nervecelleaktivering. En række kunstigt inducerede mutationer er tilgængelige for at ændre proteinets egenskaber. For eksempel, det er muligt at øge den strøm, det genererer, eller ændre bølgelængden af lys, det reagerer på. Sådanne modifikationer gør det muligt for forsøgspersoner at arbejde med proteiner, der er skræddersyet til deres behov. Forskere kan endda kombinere adskillige proteinvarianter for en tydelig respons ved forskellige bølgelængder af lys.
De fleste af de mutationer, der er brugt til at modificere egenskaberne af ChR2, er indtil videre blevet introduceret mere eller mindre tilfældigt - enten via rettet evolution eller baseret på data om kendte proteinstrukturer. Det nærmeste forskere nogensinde er kommet på en realistisk ChR2-struktur er en mærkelig kombination kaldet C1C2, 70 procent af dem er baseret på ChR1, et beslægtet protein, med resten baseret på den faktiske ChR2. Denne blandede struktur kan ikke tage højde for alle proteinets egenskaber. Som resultat, mutationerne forudsagt af denne model er ikke helt realistiske og er derfor af begrænset interesse for optogenetik.
For at afsløre strukturen af ChR2, forfatterne af undersøgelsen brugte en analytisk teknik kaldet røntgendiffraktion, som kun virker med prøver i form af en krystal. Disse blev opnået af forskerne via in meso krystallisation. Det vil sige, proteinkrystallerne blev dyrket i den såkaldte kubiske lipid mesofase - et medium, der tillader proteiner at bevæge sig frit uden at forlade membranen. For at bestemme proteinstrukturer, deres krystaller blev bestrålet med røntgenstråler ved en bølgelængde på omkring 1 ångstrøm, hvilket er lidt mindre end længden af bindingerne mellem atomerne i proteinet. I røntgenkrystallografi, strukturer udledes ved at analysere, hvordan stråling spredes af en prøve.
"Forsøg på at løse strukturen af ChR2 går helt tilbage til tidspunktet for dets opdagelse i 2003. Men på trods af indsatsen fra adskillige forskningsgrupper fra hele verden, strukturen af proteinet i dets naturlige tilstand er forblevet ukendt, " siger Valentin Borshchevskiy, en af forfatterne til papiret og stedfortrædende leder af Laboratory for Advanced Studies of Membrane Proteins på MIPT. "Nu hvor vi har strukturen, meningsfulde mutationer kan indføres i proteinet for at tilpasse dets egenskaber til kravene i et specifikt eksperiment. kender ikke strukturen, vi var nødt til at finde ud af de nyttige mutationer ved at prøve og fejle eller nøjes med dataene om relaterede proteiner."
Sidste artikelGrafisk australsk video af japansk hvalfangst frigivet
Næste artikelTeam afslører regler for fremstilling af ribben
 Varme artikler
Varme artikler
-
 En våd vinter kan ryste op i San Francisco Bays invasive arterTunikaten Ciona robusta rangerer som en af San Francisco Bays mest dominerende angribere. Men den har brug for saltvand for at trives, og dets antal faldt, da en enkelt våd vinter sendte ferskvand
En våd vinter kan ryste op i San Francisco Bays invasive arterTunikaten Ciona robusta rangerer som en af San Francisco Bays mest dominerende angribere. Men den har brug for saltvand for at trives, og dets antal faldt, da en enkelt våd vinter sendte ferskvand -
 Pumaer er mere sociale end hidtil antagetPumaer er ikke så ensomme, som de engang så ud til. Her, to bjergløver deler mad i Wyoming. Kredit:Mark Ellbroch/Panthera Pumas, længe kendt som solitære kødædere, er mere sociale end hidtil antag
Pumaer er mere sociale end hidtil antagetPumaer er ikke så ensomme, som de engang så ud til. Her, to bjergløver deler mad i Wyoming. Kredit:Mark Ellbroch/Panthera Pumas, længe kendt som solitære kødædere, er mere sociale end hidtil antag -
 Globalt forskerhold udfylder sproggabet i plantevidenskabWashington State University plantecellebiolog Andrei Smertenko. Kredit:Robert Hubner, WSU Photo Services For at holde trit med det hurtigt udviklende studie af cellulær plantevidenskab, et interna
Globalt forskerhold udfylder sproggabet i plantevidenskabWashington State University plantecellebiolog Andrei Smertenko. Kredit:Robert Hubner, WSU Photo Services For at holde trit med det hurtigt udviklende studie af cellulær plantevidenskab, et interna -
 Undersøgelser af havdyr tyder på, at nervesystemet har udviklet sig uafhængigt flere gangeProporus sp., en xenacoelomorph. Kredit:Wikipedia/CC BY 2.5 (Phys.org) – Et team af forskere fra Norge, Sverige og Danmark har fundet beviser, der tyder på, at nervesystemet har udviklet sig uafhæ
Undersøgelser af havdyr tyder på, at nervesystemet har udviklet sig uafhængigt flere gangeProporus sp., en xenacoelomorph. Kredit:Wikipedia/CC BY 2.5 (Phys.org) – Et team af forskere fra Norge, Sverige og Danmark har fundet beviser, der tyder på, at nervesystemet har udviklet sig uafhæ
- Kontrol af neuroner med lys - men uden ledninger eller batterier
- Nanodots gennembrud kan føre til et bibliotek på én chip
- Sådan oprettes et elektromagnetisk felt
- Ny lufttrykssensor kan forbedre hverdagens enheder
- Fyrtårn:Hjemmeskærm er én smart vagtpost
- Entangled-photon gyroskop overvinder klassisk grænse


