Undersøgelse identificerer mekanismer, der fremmer bakteriel overlevelse
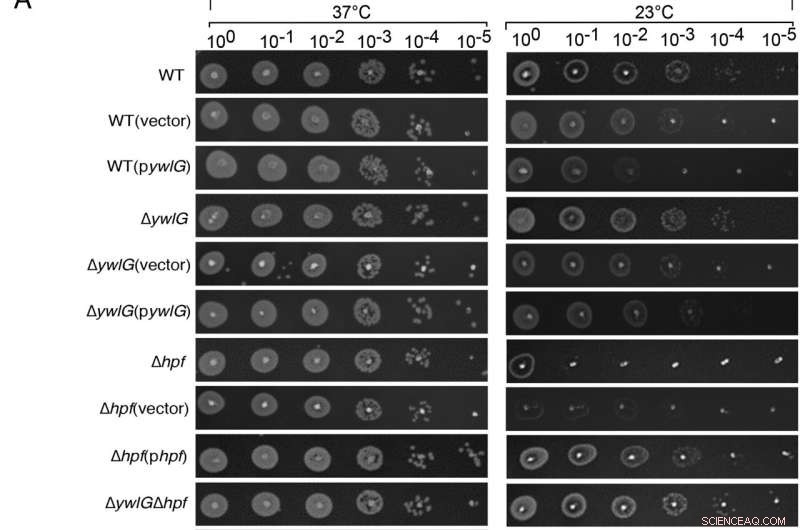
Inaktivering af ywlG undertrykker kuldefølsomheden af en Δhpf-nul mutant på en mediumafhængig måde. Komplementering med plasmid-kodet ywlG og hpf bekræftede den YwlG-medierede suppression og HPF-afhængige kulderespons. Seriefortyndingspotassays blev udført på (A) lysogen bouillon (LB)-baserede eller (B) tryptiske sojabouillon (TSB)-baserede agarplader. Eksponentielt voksende celler (OD600 =0,6) i TSB blev justeret til OD600 =0,2 efter to vaske i 1xPBS. Efter serielle fortyndinger blev 2 µL af hver fortynding plettet på agarpladerne. Resultaterne blev registreret efter 24 timers og 48 timers inkubation ved henholdsvis 37 °C og 23 °C. Billederne er repræsentative for tre uafhængige eksperimenter. Kredit:Proceedings of the National Academy of Sciences (2022). DOI:10.1073/pnas.2207257119
Northwestern Medicine-forskere har afsløret nye reguleringsmekanismer, der fremmer bakteriel overlevelse, ifølge resultater offentliggjort i Proceedings of the National Academy of Sciences .
Undersøgelsen, ledet af M.-N. Frances Yap, Ph.D., lektor i mikrobiologi-immunologi, lægger også grunden til at identificere nye terapeutiske mål til behandling af bakterielle infektioner.
Ribosomdvale er en mekanisme, der udføres af bakterier og andre organismer, herunder eukaryoter, for at sikre langsigtet overlevelse. Hibernerende 100S-ribosomer i bakterier består af to 70S-komplekser, der er forbundet med et protein til dvalefremmende faktor (HPF).
Dette 100S-kompleks tjener to hovedformål:at forhindre nedbrydning af proteinbiosyntesemaskineri (ribosomer) og at spare energi i cellen ved at lukke ned for mRNA-translation.
I den nuværende undersøgelse brugte Yaps team massespektrometri til at studere proteininteraktioner i methicillin-resistente Staphylococcus aureus, en bakterie, der almindeligvis er kendt for at forårsage staph-infektioner. Ud fra disse analyser fandt de ud af, at HPF interagerer med en tidligere uidentificeret bindingspartner placeret uden for ribosomet, et protein kaldet YwlG.
Ved at løse YwlG's atomare struktur fandt de desuden ud af, at dette protein er involveret i glutamathydrogenaseaktivitet, som er en essentiel metabolisk vej, der kræves for bakteriers overlevelse.
"Under normale forhold er en brøkdel af YwlG-protein bundet til HPF. Ved at binde sammen kan YwlG ikke stimulere glutamathydrogenaseaktivitet, og HPF kan ikke binde til ribosomet, så det er 'gensidig sekvestrering' af de to proteiner for at sikre den rigtige mængde af 100S-komplekser og cellulær glutamatdehydrogenase produceres," sagde Yap.
Resultaterne peger på både HPF og YwlG som faktorer, der påvirker bakteriel kolonisering og infektions sværhedsgrad. Slutmålet er ifølge Yap at identificere en forbindelse, der kan forstyrre dannelsen af disse komplekser og til gengæld hæmme langsigtet overlevelse af bakterier.
"En vigtig fordel er, at protein, der ligner HPF eller YwlG, ikke findes hos mennesker, så du kan udvikle et HPF- eller YwlG-målrettet antibakterielt middel, der hæmmer bakterievækst, men ikke skader værterne," sagde Yap. + Udforsk yderligere
Hibernerende ribosomer hjælper bakterier med at overleve
 Varme artikler
Varme artikler
-
 Chimpansedødsfald i Uganda skyldes menneskelig forkølelsesvirusEn to-årig chimpanse ved navn Betty, der bukkede under for virussen. Kredit:Richard Wrangham I det vilde, chimpanser står over for en række alvorlige trusler, lige fra krybskytter til rovdyr til s
Chimpansedødsfald i Uganda skyldes menneskelig forkølelsesvirusEn to-årig chimpanse ved navn Betty, der bukkede under for virussen. Kredit:Richard Wrangham I det vilde, chimpanser står over for en række alvorlige trusler, lige fra krybskytter til rovdyr til s -
 Hvad gør den temporale flamme?Alle pattedyrs hjerner indeholder to halvdele, kendt som venstre hjerne og højre hjerne. Hver side af hjernen er derefter opdelt i fire lobber. Hjernen har også yderligere to strukturer, der kaldes hj
Hvad gør den temporale flamme?Alle pattedyrs hjerner indeholder to halvdele, kendt som venstre hjerne og højre hjerne. Hver side af hjernen er derefter opdelt i fire lobber. Hjernen har også yderligere to strukturer, der kaldes hj -
 Definitionen af kropssystemerDen menneskelige krop består af flere systemer, der arbejder sammen om at danne liv. Kropssystemer er en organiseret gruppe væv, der danner en bestemt funktion. Disse funktioner fungerer med andre
Definitionen af kropssystemerDen menneskelige krop består af flere systemer, der arbejder sammen om at danne liv. Kropssystemer er en organiseret gruppe væv, der danner en bestemt funktion. Disse funktioner fungerer med andre -
 Sådan bliver du glad i et forholdHvert øjeblik som dette er belønningen for hårdt arbejde. Dougal Waters Photography Ltd/Digital Vision/Getty Images Når du leder efter kærlighed, at være i et forhold lyder som om det ville være nok
Sådan bliver du glad i et forholdHvert øjeblik som dette er belønningen for hårdt arbejde. Dougal Waters Photography Ltd/Digital Vision/Getty Images Når du leder efter kærlighed, at være i et forhold lyder som om det ville være nok
- Forbedring af målinger af overfladeviskositet af filamenter og membraner
- Laseropvarmning rammer plet
- Forebyggelse af farvestofsammenlægning med smeltede salte for at forbedre solcellernes ydeevne
- Ny mekanisme muliggør lavere energibehov til OLED -skærme
- Spidey sanser kunne hjælpe autonome maskiner med at se bedre
- Red tide voksede drastisk langs Floridas vestkyst på mindre end en måned


