Forskere dechifrerer, hvordan et enzym modificerer det genetiske materiale i cellekernen
PRMT5 tilhører en familie af enzymer kaldet protein arginin methyltransferaser, som er ansvarlige for at tilføje methylgrupper til specifikke arginin aminosyrer i proteiner. I tilfælde af PRMT5 målretter og methylerer det specifikt histonproteiner, som er essentielle komponenter i kromatin, den komplekse struktur, der pakker DNA inde i cellekernen.
Gennem detaljerede biokemiske og strukturelle undersøgelser afslørede forskerne de præcise molekylære interaktioner, der forekommer mellem PRMT5 og histoner. De identificerede nøgleaminosyrer og bindingssteder i enzymet, som er afgørende for dets evne til at genkende og methylere specifikke histonhaler.
Forskerne opdagede også den sekventielle rækkefølge, hvori PRMT5 modificerer histoner og tilføjer methylgrupper til forskellige steder på en trinvis måde. Denne sekventielle methyleringsproces fører til specifikke mønstre af histonmodifikationer, som igen påvirker genekspression.
At forstå de molekylære mekanismer bag PRMT5's aktivitet har betydelige konsekvenser for forskellige områder af biologi og medicin. Dysregulering af PRMT5-aktivitet er blevet forbundet med flere sygdomme, herunder visse typer kræft og neurologiske lidelser. Ved at opnå en dybere forståelse af PRMT5s funktioner, kan forskere udforske potentielle terapeutiske strategier, der modulerer dets aktivitet og genopretter normale cellulære processer.
Dette gennembrud i forståelsen af enzymmedierede histonmodifikationer baner vejen for fremtidige undersøgelser af kromatin-dynamik og genregulering. Det åbner nye veje til at tyde det komplekse samspil mellem epigenetiske modifikationer og cellulære processer, hvilket giver værdifuld indsigt i fundamentale biologiske mekanismer og sygdomsudvikling.
Sidste artikelAfdække hemmelighederne om, hvordan kromosomer samles
Næste artikelHvordan opstod Dimorphos?
 Varme artikler
Varme artikler
-
 Hvordan gårde kunne hjælpe med at forsvare jordens eget mikrobiomKredit:Paul Mocan/Unsplash Der skal træffes foranstaltninger for at bevare, genoprette og håndtere mangfoldigheden af mikrober, der lever i jordmiljøer for at forhindre deres udryddelse, ifølge e
Hvordan gårde kunne hjælpe med at forsvare jordens eget mikrobiomKredit:Paul Mocan/Unsplash Der skal træffes foranstaltninger for at bevare, genoprette og håndtere mangfoldigheden af mikrober, der lever i jordmiljøer for at forhindre deres udryddelse, ifølge e -
 Har planter et mikrobiom?Kredit:A3pfamily, Shutterstock Vores kroppe er hjemsted for billioner af usynlige mikroorganismer, herunder bakterier, svampe, vira og smådyr. Disse lever på vores hud, i vores mund, selv i vores c
Har planter et mikrobiom?Kredit:A3pfamily, Shutterstock Vores kroppe er hjemsted for billioner af usynlige mikroorganismer, herunder bakterier, svampe, vira og smådyr. Disse lever på vores hud, i vores mund, selv i vores c -
 Sådan fungerer kropsdysmorfisk lidelsePersoner med kropsdysmorfisk lidelse kan ikke se deres sande refleksion. I stedet, de ser store fejl og mangler, trods andres forsikringer. Group/AsiaPix/Getty Images Mange af os har de øjeblikke, hv
Sådan fungerer kropsdysmorfisk lidelsePersoner med kropsdysmorfisk lidelse kan ikke se deres sande refleksion. I stedet, de ser store fejl og mangler, trods andres forsikringer. Group/AsiaPix/Getty Images Mange af os har de øjeblikke, hv -
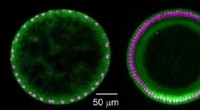 Forskere finder, at diffusion spiller en usædvanlig signalrolle i Drosophila-embryonerDiffusion får signalet (Dorsale proteiner; grønt) til at koncentrere sig på den ventrale (nederste) side af embryoet over tid. Venstre side:Tværsnit af ungt embryo, 1-1,5 time gammel, med ensartede mæ
Forskere finder, at diffusion spiller en usædvanlig signalrolle i Drosophila-embryonerDiffusion får signalet (Dorsale proteiner; grønt) til at koncentrere sig på den ventrale (nederste) side af embryoet over tid. Venstre side:Tværsnit af ungt embryo, 1-1,5 time gammel, med ensartede mæ
- Forsker udvikler blødt materiale til at bevare biologisk medicin
- Hvordan bliver du ufolog?
- Kvanteinspireret tilgang sænker dramatisk lysstyrken, der er nødvendig for optisk kohærenstomogra…
- Neptun og ringe skinner på billeder fra nyt rumteleskop
- Prangende første billeder ankommer fra NOAAs GOES-16 lynkortlægger
- Klimapionerer:hvordan småbønder kunne gå forrest mod bæredygtigt landbrug


