Hvad er betydningen af h20 i naturvidenskab?
1. Universal opløsningsmiddel :Vand omtales ofte som det "universelle opløsningsmiddel" på grund af dets exceptionelle evne til at opløse en lang række stoffer, herunder ioniske forbindelser, polære molekyler og endda nogle ikke-polære stoffer. Denne egenskab gør det muligt for vand at fungere som et medium for kemiske reaktioner, transportere næringsstoffer og lette adskillige biologiske processer.
2. Sammenhæng og adhæsion :Vandmolekyler udviser stærke sammenhængskræfter på grund af hydrogenbinding, som får vanddråber til at dannes og blive sammen. Samhørighed bidrager også til overfladespænding, hvilket gør det muligt for insekter som vandstridere at gå på vandet. Derudover har vand en høj klæbende egenskab, der gør det muligt for det at klæbe til overflader og stige gennem smalle rør (kapillærvirkning), der er afgørende for transport af vand i planter og absorption i papirservietter.
3. Høj varmekapacitet :Vand har en usædvanlig høj varmekapacitet, hvilket betyder, at det kan absorbere eller frigive en stor mængde varme med relativt små temperaturændringer. Denne egenskab er afgørende for at regulere jordens temperatur, forhindre drastiske udsving og stabilisere miljøet for liv.
4. Termisk udvidelsesanomali :Vands densitet stiger, når temperaturen falder fra stuetemperatur til 4°C, men falder derefter, når temperaturen falder yderligere. Denne usædvanlige adfærd er kendt som den "termiske ekspansionsanomali" og tillader is at flyde på vandet, hvilket skaber et isolerende lag, der beskytter akvatiske økosystemer mod frysning.
5. pH og syre-base kemi :Vand gennemgår autoionisering, hvor et lille antal vandmolekyler dissocierer til brint (H+) og hydroxid (OH-) ioner, hvilket resulterer i en neutral pH på 7. Denne fundamentale egenskab er afgørende for at opretholde pH balance i biologiske systemer, enzymaktivitet, og kemiske reaktioner.
6. Hydrolysereaktioner :Vandmolekyler spiller en afgørende rolle i hydrolysereaktioner, hvor kemiske bindinger brydes ved tilsætning af vand. Hydrolyse er fundamental i adskillige biologiske processer såsom fordøjelse, nedbrydning af komplekse molekyler til mindre komponenter, der kan absorberes af celler.
7. Struktur af DNA og RNA :Vand er afgørende for den strukturelle stabilitet og funktion af DNA (deoxyribonukleinsyre) og RNA (ribonukleinsyre), de molekyler, der er ansvarlige for at bære genetisk information. Vandmolekyler danner hydrogenbindinger med de nitrogenholdige baser af disse nukleinsyrer og bevarer deres specifikke strukturer, der er afgørende for biologisk funktion.
8. Hydration Shell :Vandmolekyler danner en hydreringsskal omkring ioner, molekyler og andre ladede partikler i vandige opløsninger. Denne skal påvirker molekylær adfærd, opløselighed og interaktioner i kemiske og biologiske systemer.
9. Habitat for vandorganismer :Vand er det primære levested for vandplanter og -dyr, hvilket giver opdrift, næring og et medium til bevægelse og reproduktion. Det understøtter forskellige økosystemer lige fra ferskvandsområder til oceaner, opretholder indviklede fødevæv og biodiversitet.
Sammenfattende er vand (H2O) af afgørende betydning i videnskaben på grund af dets unikke egenskaber som et universelt opløsningsmiddel, dets rolle i regulering af temperaturen, dets involvering i kemiske reaktioner, dets betydning for biologiske processer og dets væsentlige habitatfunktion. At forstå og studere H2O har været afgørende for fremskridt inden for kemi, biologi, miljøvidenskab og mange andre videnskabelige områder.
Sidste artikelHvad er kilden til peptidase?
Næste artikelHvad er pH-værdien af terpentin?
 Varme artikler
Varme artikler
-
 En naturlig svampestamme kunne rense olieudslip og give livet tilbage til Albertas oliesandTomatfrøplanter behandlet med svampen (til højre) blomstrede på tailings. Kredit:University of Saskatchewan De nuværende metoder til at genoprette disse steder er ikke så omkostningseffektive elle
En naturlig svampestamme kunne rense olieudslip og give livet tilbage til Albertas oliesandTomatfrøplanter behandlet med svampen (til højre) blomstrede på tailings. Kredit:University of Saskatchewan De nuværende metoder til at genoprette disse steder er ikke så omkostningseffektive elle -
 Tobaksplanter som livreddereQUT-forskeres arbejde med at sekventere genomet af australsk hjemmehørende tobaksplante Nicotiana benthamiana vil understøtte Newcotiana-projektets forskning for at udvikle nye varianter af ikke-ryg
Tobaksplanter som livreddereQUT-forskeres arbejde med at sekventere genomet af australsk hjemmehørende tobaksplante Nicotiana benthamiana vil understøtte Newcotiana-projektets forskning for at udvikle nye varianter af ikke-ryg -
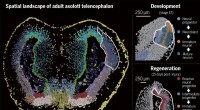 Det første spatiotemporale kort over hjerneregenerering i axolotlUdvikling og regenerering af axolotl telencephalon. Det rumligt opløste enkeltcelle-transkriptom af den voksne axolotl-telencephalon som bestemt ved Stereo-seq-analyser (til venstre). Ved hjerneskade
Det første spatiotemporale kort over hjerneregenerering i axolotlUdvikling og regenerering af axolotl telencephalon. Det rumligt opløste enkeltcelle-transkriptom af den voksne axolotl-telencephalon som bestemt ved Stereo-seq-analyser (til venstre). Ved hjerneskade -
 Sådan fungerer Gene DopingDen virtuelle Michael Phelps og den ægte svømmer Park Tae-Hwan i badetøjet, der fik folk til at summe om kropslig forbedring Toru Yamanaka/AFP/Getty Images Michael Phelps delte rampelyset ved OL i Be
Sådan fungerer Gene DopingDen virtuelle Michael Phelps og den ægte svømmer Park Tae-Hwan i badetøjet, der fik folk til at summe om kropslig forbedring Toru Yamanaka/AFP/Getty Images Michael Phelps delte rampelyset ved OL i Be
- Hvorfor britiske jernbaner ikke kan håndtere hedebølger – og hvad kan hjælpe
- Gammel nordisk plyndringstaktik inspirerer Oslo -teamet til at kalde Android -fejl StrandHogg
- Corona-pandemien gør den amerikanske boligkrise endnu værre
- Sådan fungerer lysmikroskoper
- 10 tips til at håndtere skovbrandsrøg, fra en folkesundhedsekspert
- Tanzanias seneste afrikanske nation forbyder plastikposer


