Hvor mange uparrede elektroner har silicium og lithium?
silicium (SI)
* Elektronisk konfiguration: 1S² 2S² 2P⁶ 3S² 3P²
* Valenselektroner: 3S² og 3p² elektroner er valenselektroner.
* uparrede elektroner: 3P -underskalet har to elektroner, og hver P orbital kan maksimalt indeholde 2 elektroner. Da der er tre P -orbitaler, vil de to valenselektroner i 3P -underskalet besætte separate orbitaler med deres spins justeret i samme retning (Hunds regel). Derfor har silicium 2 uparrede elektroner .
lithium (Li)
* Elektronisk konfiguration: 1S² 2S¹
* Valenselektroner: 2S¹ -elektronet er valenselektronen.
* uparrede elektroner: Da 2'erne orbital kan indeholde to elektroner, og der er kun en elektron til stede, vil den være uparret. Derfor har lithium 1 uparret elektron .
 Varme artikler
Varme artikler
-
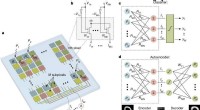 In-sensor computing for at fremskynde maskinsynen, Illustration af ANN fotodiode array. Alle subpixels med samme farve er forbundet parallelt for at generere M udgangsstrømme. b, Kredsløbsdiagram af en enkelt pixel i fotodiodearrayet. c, d, Skema
In-sensor computing for at fremskynde maskinsynen, Illustration af ANN fotodiode array. Alle subpixels med samme farve er forbundet parallelt for at generere M udgangsstrømme. b, Kredsløbsdiagram af en enkelt pixel i fotodiodearrayet. c, d, Skema -
 Broen i Italien havde et usædvanligt design, påkrævet konstant arbejde (Opdatering)En udsigt over de evakuerede huse bygget under resterne af den kollapsede Morandi motorvejsbro, i Genova, det nordlige Italien, Onsdag, 15. august, 2018. En bro på en hovedvej, der forbinder Italien m
Broen i Italien havde et usædvanligt design, påkrævet konstant arbejde (Opdatering)En udsigt over de evakuerede huse bygget under resterne af den kollapsede Morandi motorvejsbro, i Genova, det nordlige Italien, Onsdag, 15. august, 2018. En bro på en hovedvej, der forbinder Italien m -
 Biodiesel-biprodukt hjælper brændstoffet med at blive rentKunstnerisk fremstilling, der skildrer et renere miljø inden for forbrændingscylinderen på en køretøjsmotor, der fremhæver koblingen mellem ren forbrænding og en bæredygtig fremtid. Kredit:KAUST; Xavi
Biodiesel-biprodukt hjælper brændstoffet med at blive rentKunstnerisk fremstilling, der skildrer et renere miljø inden for forbrændingscylinderen på en køretøjsmotor, der fremhæver koblingen mellem ren forbrænding og en bæredygtig fremtid. Kredit:KAUST; Xavi -
 Forskere udvikler en ny metode til at forringe billederModellen kan trænes i farten til at udsende billeder i høj kvalitet på kun 12 sekunder. Kredit:Bochang Moon fra Gwangju Institute of Science and Technology, Korea Computergrafik af høj kvalitet, me
Forskere udvikler en ny metode til at forringe billederModellen kan trænes i farten til at udsende billeder i høj kvalitet på kun 12 sekunder. Kredit:Bochang Moon fra Gwangju Institute of Science and Technology, Korea Computergrafik af høj kvalitet, me
- Hvad er årsagen til støvkoncentrationer over Østasien?
- NIST how-to websted dokumenterer procedurer for nano-EHS forskning og test
- High-fidelity-simuleringer viser vejen til optimering af varmeoverførsel i nuværende og næste gen…
- Undersøgelse afslører mangler i processen med at vedligeholde statens vælgerlister
- Hvad gør udtrykket, der beskriver, hvordan et mineral reflekterer lys fra dens overflade?
- Ørkenmyrer er i stand til at vurdere pålideligheden af vartegn, når de søger efter vejen hjem


