Lysmikroskopi giver et dybt kig på proteinstrukturen
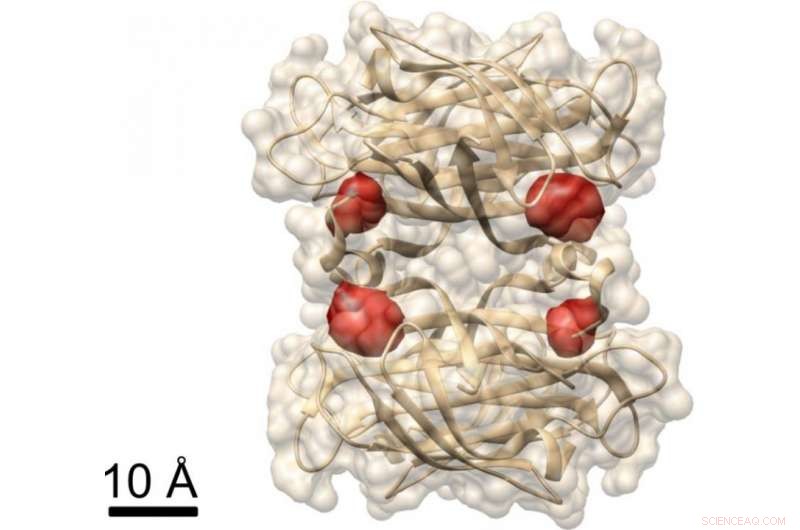
Visning af et protein:Max Planck -forskere har brugt COLD -metoden til at visualisere de fire bindingssteder for biotin (mærket med røde farvestofmolekyler) i proteinet streptavidin, hvis struktur allerede er kendt. Kredit:MPI for Science of Light
Lysmikroskopi afslører fortsat den mikroskopiske verden med en stadig større opløsning. Ved hjælp af en ny metode, der blev fremstillet KOLD, forskere ved Max Planck Institute for the Science of Light i Erlangen har nu visualiseret proteinstrukturer med en opløsning på omkring 5 Å. COLD opnår denne hidtil usete opløsning ved at arbejde ved en temperatur på minus 270 grader Celsius. Ved så lave temperaturer, signaler fra fluorescerende proteiner kan lokaliseres mere præcist. Metoden åbner derved muligheden for lave temperaturer, signaler fra fluorescerende proteiner kan lokaliseres mere præcist. Metoden åbner derved mulighed for at observere strukturelle ændringer af proteiner forbundet med specifikke sygdomme.
Indtil slutningen af det 20. århundrede, lysmikroskoper var underlagt en stor begrænsning:deres opløsning var begrænset af lysets bølgetype. Allerede i 1873, fysikeren Ernst Abbe formulerede en lov, der, i forenklede vendinger, hedder det, at et optisk mikroskop ikke kan løse strukturer, der måler mindre end halvdelen af bølgelængden af synligt lys - omkring 200 nanometer. "Dette svarer til en kæde på flere tusinde atomer, "forklarer Vahid Sandoghdar, Direktør ved Max Planck Institute for the Science of Light.
Denne grænse blev betragtet som uoverstigelig-indtil forskere udviklede fluorescensmikroskopimetoder med superopløsning, såsom STED og PALM / STORM, inden for de sidste to årtier. Disse teknikker forbedrede den optiske opløsning til omkring 20 til 30 nanometer. I 2014, forskerne involveret i disse opfindelser, herunder Stefan Hell ved Max Planck Institute for Biophysical Chemistry i Göttingen, fik Nobelprisen i kemi. For nylig, et team ledet af Helvede øgede opløsningsgrænsen med yderligere tyve gange ved hjælp af en nyudviklet mikroskopiteknik kendt som MINFLUX. Opløsningen af denne metode var tilstrækkelig til at skelne nabomolekyler, der er kun få nanometer fra hinanden.
COLD tillader et indblik i individuelle proteinmolekyler
Vahid Sandoghdar og hans kolleger har arbejdet med alternative metoder til at øge ydeevnen for fluorescensmikroskopi i høj opløsning i flere år nu-med stor succes, som Erlangen -fysikeren rapporterer:"Vores nye tilgang giver os mulighed for at vise strukturer, der er adskilt af en afstand på mindre end fem ångstrømme, altså et halvt nanometer. Vi er derfor i stand til at undersøge proteinmolekyler. "Sandoghdar og hans kolleger præsenterede grundkonceptet for første gang i 2013, som de har udtænkt KOLD til kryogen optisk lokalisering i tre dimensioner. Navnet COLD siger det hele:"Det centrale ved COLD er den lave temperatur, hvor målingerne finder sted, omkring minus 270 grader Celsius, "siger fysikeren.
Grundprincippet for fluorescensbilleddannelse er det samme for alle mikroskoper:Prøven mærkes først kemisk med fluorescerende molekyler kaldet fluoroforer. Dette gør visse områder eller komponenter i prøven, f.eks. celler, synlig. Imidlertid, konventionelle teknikker er begrænset af Abbe -grænsen. Når flere fluoroforer med tæt afstand udsender lys samtidigt, deres signaler overlapper hinanden og kan ikke længere genkendes som separate punkter. Superopløsningsmetoderne, derimod, er i stand til at tænde og slukke de fluorescerende pletmolekyler. Dette gør det muligt at bestemme placeringen af hver enkelt med en relativt høj grad af præcision. Imidlertid, præcisionen lider af statistisk støj:jo mere kort tid fluoroforer udsender lys, jo større upræcision. Og normalt lyser de kun i meget kort tid, fordi lysinducerede kemiske processer blegger molekylet.
Molekyler kan lokaliseres mere præcist ved lave temperaturer
Det er her COLD spiller ind. De ekstremt lave temperaturer sænker fotoblegningen enormt, så hver fluorofor lyser i betydeligt længere tid. "Dette reducerer støj på billederne og forbedrer lokaliseringsnøjagtigheden, "siger Siegfried Weisenburger, der udførte eksperimenterne som en del af sin doktorgradsforskning i Sandoghdars afdeling.
I samarbejde med Christian Griesinger og hans afdeling ved Max Planck Institute for Biophysical Chemistry i Göttingen, Erlangen -forskerne var i stand til at bruge deres teknik til at løse to fluoroforer på et protein, der kun var et nanometer fra hinanden. I denne skala, selv de mindste vibrationer og bevægelser af prøven vil ødelægge eksperimentet. "For at måle atomskala-afstande, vi var nødt til at udvikle en særlig, ekstremt stabilt kryogent mikroskop, "Sandoghdar forklarer." Prøverne fremstilles ved at fordele proteinerne i en tynd polymerfilm på et glasglas. "
Hvordan er proteiner arrangeret i en membran?
I et andet forsøg, forskerne demonstrerede, at COLD kan bruges til at bestemme den rumlige struktur af proteiner:De mærkede et protein kaldet streptavidin på fire bestemte steder med fluoroforer og optog flere hundrede billeder. De rekonstruerede derefter proteinets struktur ved hjælp af tomografiske algoritmer. Ultimativt, de opnåede en tredimensionel opløsning på cirka et halvt nanometer ved lokalisering af de fire farvestofmolekyler. "Denne resolution tillader strukturstudier på grænsen til andre metoder inden for strukturbiologi." Dette gælder især for Christian Griesingers forskningsområde, NMR -spektroskopi, som kun kan løse afstande under fem ångstrøm. "COLD bygger bro mellem fluorescensmikroskopi og strukturel biologi, "siger Max Planck -direktøren i Göttingen.
Resultaterne er yderst relevante for en række forskere. "I celler, proteiner ændrer deres struktur for at udføre eller ændre deres funktioner. I øvrigt, specifikke strukturændringer er ofte forbundet med specifikke sygdomme, "siger Sandoghdar. Desuden er KOLD kan bestemme proteinernes orientering. "Orientering er især interessant, når man ser med proteiner i en membran. Det er formålet med vores nuværende eksperimenter, "forklarer Daniel Böning, medlem af forskergruppen i Erlangen.
Sandoghdar forventer, at opløsningen af COLD kan forbedres yderligere med en faktor ti. Teknikken ville derefter fungere på atomniveau. Imidlertid, i så fald ville det komme op imod den iboende grænse for fluorescensmikroskopi som følge af størrelsen af de anvendte etiketmolekyler. "COLD er ideel til visualisering af proteiner eller mindre aggregater af biomolekyler. På den anden side, på grund af de ugæstfrie temperaturer, teknikken kan ikke bruges til at undersøge processer i levende celler, "Sandoghdar opsummerer." I øjeblikket ingen mikroskopimetode er i stand til at observere alt. De forskellige strategier skal derfor fortsat bruges - som før og i overskuelig fremtid - på en komplementær måde. "
 Varme artikler
Varme artikler
-
 Ingeniører forudsiger, hvordan flydende væske vil bøje små hår, der beklæder blodkar og tarmeKredit:Laura Tiitto/public domain Vores kroppe er indvendigt foret med bløde, mikroskopiske tæpper af hår, fra de græsklædte extensions på vores smagsløg, til uklare senge af mikrovilli i vores ma
Ingeniører forudsiger, hvordan flydende væske vil bøje små hår, der beklæder blodkar og tarmeKredit:Laura Tiitto/public domain Vores kroppe er indvendigt foret med bløde, mikroskopiske tæpper af hår, fra de græsklædte extensions på vores smagsløg, til uklare senge af mikrovilli i vores ma -
 Lithium – det er ikke kun til batterier:Det pulveriserede metal kan reducere ustabilitet i fusionspl…Figur, der viser placeringen af de to lithiuminjektorer, samt farvebilleder af plasma før og efter lithiuminjektion. Rød angiver lys udsendt fra både deuterium og lithium, mens gul og orange viser l
Lithium – det er ikke kun til batterier:Det pulveriserede metal kan reducere ustabilitet i fusionspl…Figur, der viser placeringen af de to lithiuminjektorer, samt farvebilleder af plasma før og efter lithiuminjektion. Rød angiver lys udsendt fra både deuterium og lithium, mens gul og orange viser l -
 Ultra-energieffektiv magnetisk hukommelse ved at kontrollere atomernes formerFigur.1.(Venstre) Transmissionselektronmikroskopibillede. Vi forberedte FePt nanoskala magnet, som er atomisk styret. (Til højre) Vi påførte eksterne spændinger til at prøve og udførte synkrotron rønt
Ultra-energieffektiv magnetisk hukommelse ved at kontrollere atomernes formerFigur.1.(Venstre) Transmissionselektronmikroskopibillede. Vi forberedte FePt nanoskala magnet, som er atomisk styret. (Til højre) Vi påførte eksterne spændinger til at prøve og udførte synkrotron rønt -
 Forskere observerer laserdrevne tin-ejecta-mikrojet-interaktionerDenne grafik afbilder sekvenser af røntgenbilleder af interagerende plane tin-ejecta-mikrostråler. Kredit:Lawrence Livermore National Laboratory De eksperimentelle observationer af højhastigheds-p
Forskere observerer laserdrevne tin-ejecta-mikrojet-interaktionerDenne grafik afbilder sekvenser af røntgenbilleder af interagerende plane tin-ejecta-mikrostråler. Kredit:Lawrence Livermore National Laboratory De eksperimentelle observationer af højhastigheds-p
- Sådan beregnes radien fra omkredsen
- Ulovlig stofbrug kan være højere end hidtil antaget; svæver under særlige begivenheder
- Hvad er nogle af de mest almindelige anvendelser af gær?
- Takster fører til kreative forsyningskæder
- Massiv asteroide, der passerer tæt på jorden i september,
- Mindst fem døde i USA, da nedgraderede Isaias når Canada


