Foldebiomolekylemodel viser, hvordan form dikterer funktion
Proteiner er fundamentale makromolekyler for livet, med en mangfoldighed af funktioner, som at fungere som kanaler gennem cellevægge, katalysatorer, DNA bøjere, osv. Når det kommer til disse funktioner, det, der betyder noget, er layoutet af de sekundære grene, består af hvert proteins aminosyrer, såsom alanin, glutamin, arginin, phenylalanin og tyrosin. Disse stabiliseres hovedsageligt af svage interaktioner - såsom hydrogenbindinger, intramolekylære interaktioner, og intermolekylære dispersive kræfter, -mellem rygraden og den laterale kæde af deres aminosyrer.
I en ny undersøgelse offentliggjort i EPJ D , Jorge González fra universitetet i Baskerlandet, i Leioa, Spanien og kolleger har udviklet en teoretisk metode til at beregne den mest stabile disposition, som biomolekyler forsøger at antage, når de er sammen, eller i tæt kontakt i tilfælde, hvor bindingen er svag. De demonstrerer også, at deres model er i overensstemmelse med vores forståelse af de samme systemer opnået fra eksperimenter, såsom spektroskopisk analyse.
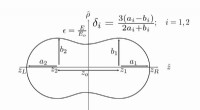
Selve størrelsen af disse molekyler forhindrer korrelation af resultaterne af konfigurationen opnået for de isolerede aminosyrer til de samme aminosyrer, der udgør de sekundære grene i strukturen af proteiner. Kendskab til den konformation, der er vedtaget af de afgrænsede aminosyrer, forfattere mener, kan være nyttige til ekstrapolering af deres egenskaber til større systemer, som polypeptider eller proteiner.
Holdet brugte først molekylær mekanik til at identificere den 3D-konformation, hvor energien af biomolekylerne ville være den mest stabile. De inkluderede derefter kvantemekaniske interaktioner i deres model for bedre at forstå strukturen og vibrationerne af de forskellige konformationer sammen med deres elektrontæthed. De analyserede derefter arten af intramolekylære kræfter i hver aminosyre ved hjælp af bindingstyper som hydrogenbindinger.
De fandt ud af, at de 15 mest stabile konformationer, der blev undersøgt, havde isolerede aminosyrer, hvis struktur ligner dem, der findes i proteiner. Imidlertid, de spiller en anden rolle i de undersøgte aminosyrer, afhængig af karakteren af deres laterale kæde.
Sidste artikelImaging hvordan magnetisme surfer
Næste artikelEn ny metode giver bedre indsigt i den virkelige verden af netværksudvikling
 Varme artikler
Varme artikler
-
 Løsning af et mysterium:En ny model til at forstå, hvordan visse kerner splittesDa kernen bliver opdelt i to fragmenter, det gennemgår deformationer, der skal redegøres præcist for i modeller for at kunne foretage præcise forudsigelser. Kredit: Videnskabelige rapporter Forsk
Løsning af et mysterium:En ny model til at forstå, hvordan visse kerner splittesDa kernen bliver opdelt i to fragmenter, det gennemgår deformationer, der skal redegøres præcist for i modeller for at kunne foretage præcise forudsigelser. Kredit: Videnskabelige rapporter Forsk -
 Første forsøg med diamantamboltceller ved europæisk XFELSe ind i interaktionskammeret med revolveren for op til seks diamantamboltceller i midten. Kredit:DESY, Cornelius Strohm Den europæiske XFEL-røntgenlaser åbner nye perspektiver for højtryksforskni
Første forsøg med diamantamboltceller ved europæisk XFELSe ind i interaktionskammeret med revolveren for op til seks diamantamboltceller i midten. Kredit:DESY, Cornelius Strohm Den europæiske XFEL-røntgenlaser åbner nye perspektiver for højtryksforskni -
 Zirconium isotop en mester i neutronfangstLLNL -forskere har afsløret, hvordan en radioaktiv isotop af elementet zirconium er 100, 000 mere sandsynligt end forventet at absorbere enhver rumtemperatur neutron, den støder på. Kredit:Lawrence Li
Zirconium isotop en mester i neutronfangstLLNL -forskere har afsløret, hvordan en radioaktiv isotop af elementet zirconium er 100, 000 mere sandsynligt end forventet at absorbere enhver rumtemperatur neutron, den støder på. Kredit:Lawrence Li -
 Kollektive orme- og robotklatter beskytter individer, sværme sammenStore grupper af californiske sortorme danner ormeklatter, der skaber kollektiv adfærd, der forbedrer overlevelsen af individuelle organismer. Kredit:Christopher Moore, Georgia Tech Individuelt,
Kollektive orme- og robotklatter beskytter individer, sværme sammenStore grupper af californiske sortorme danner ormeklatter, der skaber kollektiv adfærd, der forbedrer overlevelsen af individuelle organismer. Kredit:Christopher Moore, Georgia Tech Individuelt,
- Nye musikstile drevet af direkte udfordringer til eliten
- Sådan læses ohm på en rækkevidde multimeter
- Astronomer opdager store mængder ilt i oldtidens stjerners atmosfære
- AI -projekt om maskinlæring vil have computere til at forudse, hvilke data brugere vil have
- Klimaforskning kræver større fokus på menneskelige befolkninger
- Ny forståelse af varmeoverførsel i kogende vand kan føre til effektivitetsforbedringer i kraftvæ…


