Enkel teknik giver mulighed for nøjagtige computersimuleringer af calciumsignalering
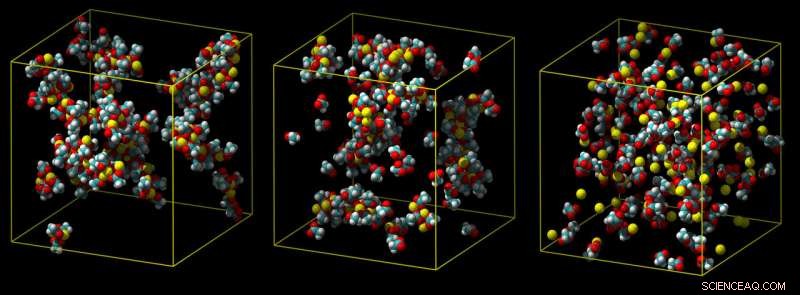
En standard calciummodel overvurderer, hvor stærkt calcium binder, fører til klumper af ionpar (venstre). En mellemmodel viser mindre sammenklumpning (midten), og en raffineret ladningsskalamodel forudsiger korrekt en svag association med carboxylgrupper i vand (ikke vist) (til højre). Kredit:Philip Mason og Elise Duboue-Dijon
Calcium er afgørende for, at vores kroppe kan fungere. Calciumioner gør det muligt for celler at kommunikere med hinanden, tillader neuroner at interagere, muskler til at trække sig sammen, og hjertets muskelceller til at synkronisere og slå. For bedre at forstå disse processer, hvor calciumioner interagerer med biologiske molekyler såsom proteiner, forskere bruger ofte computersimuleringer. Men nøjagtige modeller er udfordrende og beregningsmæssigt dyre.
"Hvis du har den forkerte model af calcium, det vil simpelthen ikke virke, " sagde Pavel Jungwirth fra Institut for Organisk Kemi og Biokemi ved Det Tjekkiske Videnskabsakademi i Prag. "De fleste af de modeller, der er tilgængelige, er ikke nøjagtige nok til at fange de vigtige træk ved calciumionen."
I denne uges udgave af Journal of Chemical Physics , imidlertid, Jungwirths forskergruppe demonstrerer, hvordan en ligetil ændring i en computermodel fører til meget nøjagtige simuleringer, som fungerer som kraftfulde værktøjer til at studere en række biologiske processer. "Jeg tror på, at vi har de bedste af de simple modeller af calcium i verden i øjeblikket, " sagde Jungwirth.
Calciumioner rejser fra celle til celle som budbringere. Når de når en celle, de binder sig til et molekyle, såsom et protein, udløser en kaskade af kemiske reaktioner. Men på grund af ionens vandige miljø, Det er svært at simulere præcis, hvordan calcium binder.
Calciumion, som er dobbelt positivt ladet, interagerer stærkt med ilterne i de omgivende vandmolekyler. Disse oxygener har en delvis negativ ladning (som i vandmolekylet), og oxygenatomet tiltrækker elektronerne i bindingerne mere effektivt. De elektrostatiske kræfter mellem calcium og vand får vandmolekylerne til at omarrangere sig omkring ionen. Calciumionen tvinger også elektronerne i vandmolekylet til at skifte, et fænomen kaldet elektronisk polarisering.
De fleste simuleringer inkorporerer omarrangering af vandmolekyler. Men fordi det kræver for meget computerkraft at beregne præcis, hvordan elektroner bevæger sig, de tager ikke højde for elektronisk polarisering. Uden elektronisk polarisering, Jungwirth sagde, simuleringer, der involverer calcium, er unøjagtige.
Typisk, interaktioner med vandmolekyler arbejder for at trække en calciumion væk fra det molekyle, den forsøger at binde sig til, som i et molekylært tovtrækkeri. Hvis en simulering ikke fuldt ud tager højde for disse effekter, det overvurderer, hvor stærkt calcium binder, producerer ioner, der ikke kan løsne sig, hvilket er urealistisk.
Et par år siden, imidlertid, Alexei Stuchebrukhov og Igor Leontyev foreslog en løsning:Sænk den elektriske ladning af ionerne i simuleringerne. Det viser sig, at skalering af ladningen med en faktor på omkring 0,75 efterligner effekten af elektronisk polarisering. En sådan simpel skalering tilføjer heller ikke nogen ekstra beregningsmæssig byrde.
"Det er næsten et mirakel, " sagde Jungwirth. "Vi ved, at det ikke er en perfekt løsning, men måske løser det 90 procent af problemet«.
Tidligere, Jungwirths team testede strategien ved at modellere den relativt simple interaktion mellem calcium- og chloridioner. For at kontrollere, om simuleringerne var nøjagtige - og om skaleringen virkede - sprængte de ægte calciumchloridopløsninger med neutroner. Ved at måle, hvordan disse neutroner spredte sig fra det vandige calciumchlorid, forskerne udledte dens struktur og sammenlignede dataene med simuleringerne.
I den nye undersøgelse, forskerne testede deres model med carboxylgrupper - molekylære grupper fundet i proteiner, og dermed mere relevant for biologi. Efter også at justere ladningen af carboxylgruppen, de viste igen, at deres simuleringer passede meget godt med data fra neutronspredningsforsøg.
Fordi carboxylgrupper er enkle sammenlignet med, sige, et helt protein, forskerne kunne også beskrive calcium-interaktionerne ved hjælp af nøjagtige, men beregningsmæssigt dyre elektroniske strukturberegninger. Ved at sammenligne disse beregninger med simuleringerne, de bekræftede igen nøjagtigheden af deres modeller.
Disse test viser, at den nye model kan simulere calcium-interaktioner med næsten ethvert protein, sagde Jungwirth. Forskerne har også udviklet en analog model, der virker for calcium-interaktioner med fosfolipider ved cellemembranen. Det næste skridt, han sagde, er at gøre det samme med DNA- og RNA-molekyler. Og længere fremme, forskerne planlægger at udvikle en lignende model for magnesium, endnu en vigtig signalion med sine egne unikke udfordringer.
 Varme artikler
Varme artikler
-
 Mikro-spektrometer åbner døren til et væld af nye smartphone-funktionerEt elektronmikroskopbillede af den perforerede membran med krystalhulrummet i midten. Detalje:krystalhulen, der fanger lys. Kredit:Eindhoven University of Technology Brug din smartphone til at kon
Mikro-spektrometer åbner døren til et væld af nye smartphone-funktionerEt elektronmikroskopbillede af den perforerede membran med krystalhulrummet i midten. Detalje:krystalhulen, der fanger lys. Kredit:Eindhoven University of Technology Brug din smartphone til at kon -
 Hyperentanglement på tværs af tagplader baner vejen mod et globalt kvanteinternetIllustration af det højdimensionale, hyperentanglement eksperiment, med et kort over Wien i baggrunden. Kredit:Steinlechner et al. Udgivet i Nature Communications. Kortdata © 2017 Google. (Phys.or
Hyperentanglement på tværs af tagplader baner vejen mod et globalt kvanteinternetIllustration af det højdimensionale, hyperentanglement eksperiment, med et kort over Wien i baggrunden. Kredit:Steinlechner et al. Udgivet i Nature Communications. Kortdata © 2017 Google. (Phys.or -
 Forskere diskuterer sandsynligheden for at finde en gluon inde i pionenEt Feynman -diagram, der viser strålingen af en gluon, når en elektron og positron tilintetgøres. Kredit:Wikimedia Commons/CC BY SA 2.5 Forskere fra NC State University har bestemt sandsynlighed
Forskere diskuterer sandsynligheden for at finde en gluon inde i pionenEt Feynman -diagram, der viser strålingen af en gluon, når en elektron og positron tilintetgøres. Kredit:Wikimedia Commons/CC BY SA 2.5 Forskere fra NC State University har bestemt sandsynlighed -
 Fotonisk kommunikation kommer til computerchipsAyar Labs optoelektroniske chips flytter data rundt med lys, men beregner elektronisk. Kredit:Ayar Labs Med nye optoelektroniske chips og et nyt partnerskab med en førende silicium-chip producent,
Fotonisk kommunikation kommer til computerchipsAyar Labs optoelektroniske chips flytter data rundt med lys, men beregner elektronisk. Kredit:Ayar Labs Med nye optoelektroniske chips og et nyt partnerskab med en førende silicium-chip producent,
- Salamander-genom giver fingerpeg om unik regenerativ evne
- pH-afhængig konformationsændring styrer energioverførsel i nanokrystal sensorer
- Materialer, der absorberer og reflekterer solenergi
- Ingeniører leverer nye nøglekomponenter for at hjælpe med at drive et fusionsenergieksperiment
- Forskere finder en måde at forbedre ydeevnen af kvantecomputere
- Hvordan anvendes fossiler i videnskab?


