Mekanismen for skift af cellulær migrationstilstand
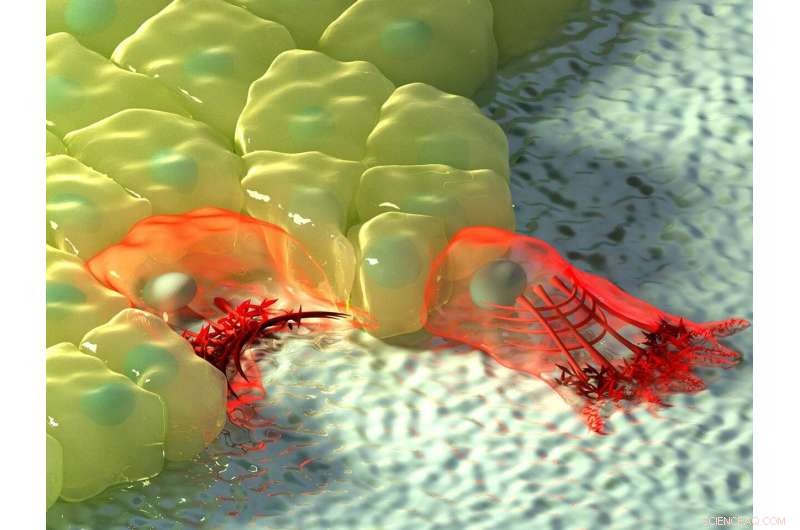
Figuren ovenfor viser en kunstnerisk illustration af celler i områder med negativ (venstre) og positiv krumning (højre). Ved negativ krumning, aktinstrømmen bevæger sig mod aktinkablet ved kanten af cellen, afbildet ved stigningen i farveintensitet, og det kontraktile kabel løfter kanten over substratet. Ved positiv krumning, lamellipodia strækker sig fra cellen til at kravle langs substratet, og disse fremspring er karakteriseret ved retrograd aktinstrøm mod indersiden af cellen. Kredit:Mechanobiology Institute, National University of Singapore
Når man står over for vanskeligt terræn, terrængående køretøjer kan skifte fra to- til firehjulstræk for at blive ved med at køre fremad. Tilsvarende cellemigration kan enten drives af fremspringsstyret crawl, eller ved kontraktile trækkræfter, men hvordan cellen skifter mellem disse to metoder forbliver et mysterium. En samarbejdsundersøgelse ledet af MBI doktorand Tianchi Chen og professor Benoit Ladoux fra Mechanobiology Institute (MBI) ved National University of Singapore, har afsløret, at den retning, som aktinfilamenterne strømmer i cellen, tillader den at fornemme den fysiske krumning af dens omgivelser, og dette retningsbestemte flow er nøglekontakten, der bestemmer, hvilken migrationsmetode der vælges. Værket blev offentliggjort i april 2019-udgaven af Naturfysik .
Krumning induceret reorganisering af actin flow
Cellemigration er en væsentlig biologisk proces, der driver vævs- og organdannelsen under embryoudvikling, og hjælper også med at beskytte kroppen gennem immunrespons og sårhelingsmekanismer. Formændringerne, der er nødvendige for cellemigration, afhænger af dynamisk organisation og kraftgenerering fra cellens indre actomyosin cytoskelet, som består af strukturelle aktinfilamenter og kontraktile myosinmotorproteiner.
Reorganisering af disse komponenter muliggør to mekanismer for cellemigration:vækst og forlængelse af actin-baserede lamellipoidale fremspring, der tillader cellen at 'kravle' udad, eller dannelsen af store kontraktile actomyosinkabler, der kan trække cellen fremad, mens de genererer trækkræfter på substratet. Imidlertid, processen, hvorved cellen vælger at danne fremspring eller kontraktile kabler, forbliver uklar.
Afhængig af topografien af det fysiske miljø, celler kan støde på områder med positiv eller negativ krumning. Positiv krumning refererer til en konveks form, der buer udad, meget ligesom et stort "D", hvorimod et eksempel på den modsatte negative krumning kan ses i bogstavet 'C', som danner en konkav form, der buer indad. Ved at observere epitelcellemigration på blomsterformede substratmønstre, der bruges til sårlukningsanalyser, en international, tværfagligt forskerhold ledet af prof Ladoux i samarbejde med MBI Principal Investigators lektor Boon Chuan Low og lektor Yusuke Toyama, sammen med teoretiske fysikere og forskningskolleger i Frankrig, Chile, Israel og Spanien fandt, at i regioner med positiv krumning, celler udviklede lamellipodia til cellegennemgang, og i områder med negativ krumning, stærke aktin kabler samlet, der fulgte den konkave kant.
Yderligere observation af actin-dynamik i realtid ved hjælp af levende cellemikroskopi afslørede en forskel i retningen af actinflow ved de to krumninger. Ved positiv krumning induceret lamellipodia, strømmen af actin var retrograd, altså væk fra cellemembranen i modsat retning af fremspringet. Omvendt ved negative krumninger var aktinstrømmen anterograd, altså mod cellemembranen, hvor aktinkablet var placeret.
Dette anterograd flow driver samlingen af distinkte, polariserede actinstrukturer ved disse områder med negativ krumning. Aktin-kablet ved den konkave kant er placeret foran, efterfulgt af tværgående aktinfibre, der er orienteret i samme retning som aktinkablet, og der bringer bagsiden af netværket op, er radiale aktinfibre orienteret i 90 grader i forhold til aktinkablet. Interessant nok, dannelsen af disse polariserede actinstrukturer som reaktion på negativ krumning blev observeret i enkeltceller og celleark, der migrerede på en 2-D overflade, og i celler indlejret i 3-D fibrøse netværk. Mens disse resultater bekræftede eksistensen af to mekanismer for cellemigration, der var stadig et åbent spørgsmål om, hvordan celler var i stand til at fornemme krumningen af miljøet.
Heldigvis, billeddannelsen af levende celler gav forskerne et potentielt fingerpeg - omskifteren i retning af aktinstrøm afhængig af krumning kunne potentielt være 'sensoren' til at skifte migrationsmåden. Dette blev bekræftet ved at udplade epitelceller på en mikromønstret overflade belagt med et klæbende substrat, som var oversået med ikke-klæbende cirkulære pletter. Da cellearket stødte på en ikke-vedhængende cirkel, lamellipodiale fremspring kravler rundt i cirklen, trække cellerne frem på det klæbende underlag. Dette skabte automatisk en konkav form på tværs af den ikke-vedhængende cirkel, som forårsagede et hurtigt skifte i retning af actomyosin flow fra retrograd til anterograd, hvilket resulterer i samling af et aktinkabel og en switch-in-migreringsmekanisme. Det kontraktile kabel kan løfte kanten af cellen op over den ikke-vedhæftende cirkel, gør det muligt at fortsætte migreringen af cellearket.
Mens celler indeholder krumningssensorer i deres membran, såsom BAR-proteiner, disse tillader kun påvisning af krumning på molekylært niveau. I det væsentlige, størrelsen af disse sensorproteiner betyder, at de kun kan mærke krumning i deres umiddelbare nærhed på en skala på nanometer, ikke på niveau med hele cellen. Imidlertid, denne undersøgelse afslører, hvordan celler kan fornemme større cellestørrelses krumningsændringer på en skala op til titusvis af mikrometer, gennem dynamisk tilpasning af aktinstrømmen.
Denne evne tillader cellen at vælge en passende mekanisme til at fortsætte migreringen, selv når de står over for forskellige ændringer i det fysiske miljø, meget ligesom hvordan et terrængående køretøj kan skifte mellem to- og firehjulstræk afhængigt af terrænet. Med den nye viden om denne aktin flow switch, videnskabsmænd kan være bedre i stand til at forstå, hvordan celler kan fortsætte migration under sårheling, eller i situationer, hvor migration kan være skadelig, såsom metastatisk progression af kræft.
 Varme artikler
Varme artikler
-
 Team udvikler optisk styret, ikke-gensidige multifunktionelle fotoniske enhederSkemaet af den optomekaniske cirkulator og retningsforstærker designet af forskergruppen. Kredit:SHEN Zhen USTC Microcavity Research Group i Key Laboratory of Quantum Information har perfektionere
Team udvikler optisk styret, ikke-gensidige multifunktionelle fotoniske enhederSkemaet af den optomekaniske cirkulator og retningsforstærker designet af forskergruppen. Kredit:SHEN Zhen USTC Microcavity Research Group i Key Laboratory of Quantum Information har perfektionere -
 Udvikling af Cd-fri kvantepunktsynteseteknologiKvantepriksyntese af en indiumphosphid-kerneskal med høj farverenhed. Kredit:Materialekemi Prof. Jong-Soo Lee og hans forskerhold fra Institut for Energividenskab og Teknik, DGIST, udviklet en grø
Udvikling af Cd-fri kvantepunktsynteseteknologiKvantepriksyntese af en indiumphosphid-kerneskal med høj farverenhed. Kredit:Materialekemi Prof. Jong-Soo Lee og hans forskerhold fra Institut for Energividenskab og Teknik, DGIST, udviklet en grø -
 Forskere belyser mekanismen for halvledernedbrydningBærerekombination i enkelte Shockley -stabelfejl (1SSFer) og ved delvise dislokationer (PDer) blev observeret, hvilket inducerede ekspansionen af 1SSFer. Kredit:NITech Forskere ved Nagoya Instit
Forskere belyser mekanismen for halvledernedbrydningBærerekombination i enkelte Shockley -stabelfejl (1SSFer) og ved delvise dislokationer (PDer) blev observeret, hvilket inducerede ekspansionen af 1SSFer. Kredit:NITech Forskere ved Nagoya Instit -
 Terahertz laser til sansning og billeddannelse overgår sine forgængereEn lille terahertz -laser designet af MIT -forskere er den første til at nå tre centrale præstationsmål på én gang:høj effekt, stram stråle, og bred frekvensindstilling. Kredit:Massachusetts Institute
Terahertz laser til sansning og billeddannelse overgår sine forgængereEn lille terahertz -laser designet af MIT -forskere er den første til at nå tre centrale præstationsmål på én gang:høj effekt, stram stråle, og bred frekvensindstilling. Kredit:Massachusetts Institute
- Valg 2020 chatter på Twitter travlt med bots, konspirationsteoretikere, undersøgelse finder
- Forskningsdetaljer mineralogi om potentielt måneudforskningssted
- Skyrmions skabt med en speciel spiral
- Forskere stabler oddsene for nye optoelektroniske 2-D-materialer
- NASAs Terra Satellite fanger slutningen på tropisk depression Kulap
- Typer af Arizona Wild Cats


