Nanoskopisk proteinbevægelse på en levende cellemembran
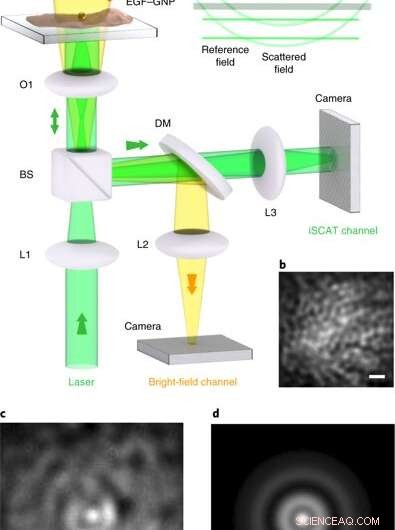
iSCAT mikroskopi på levende celler. en, Eksperimentelt arrangement af iSCAT-mikroskopet til billeddannelse af levende celler. Celler udplades i en skål med glasbund under Leibowitz-medium. (a) mikropipette leverer EGF-GNP-proberne direkte på cellekulturen, hvor de specifikt retter sig mod EGFR -proteinet i cellemembranen. Lysfeltbelysningskanalen fra oven hjælper med at inspicere kulturen, men er ikke påkrævet til iSCAT-billeddannelse. L1 – L3, linser; O1, × 100 mål; BS, 90:10 stråledeler; DM, 590 nm kortpasset dikroisk spejl. iSCAT-billeddannelse blev udført med belysningsintensiteter på 1-8 kW cm−2, som vides at være levedygtige for HeLa ved bølgelængden af interesse. Indsat, bølgefronter af felterne, der bidrager til iSCAT -signalet. (b), Et udsnit af HeLa-cellens membran før mærkning, set via refleksion iSCAT. (c), iSCAT-billede af cellemembranen inklusive en bundet EGF-GNP-probe. (d), PSF ekstraheret fra ca. Skala søjler i b–d er 1 μm. Kredit: Natur fotonik , doi:10.1038/s41566-019-0414-6
Cellulære funktioner dikteres af den indviklede bevægelse af proteiner i membraner, der spænder over en skala fra nanometer til mikrometer, inden for en tidsramme på mikrosekunder til minutter. Imidlertid, denne rige parameter i rummet er utilgængelig ved hjælp af fluorescensmikroskopi, selvom det er inden for rækkevidde af interferometrisk spredning (iSCAT) partikelsporing. Den nye iSCAT -teknik er, imidlertid, meget følsom over for enkelte og umærkede proteiner, derved forårsager uspecifik baggrundsfarvning som en væsentlig udfordring under cellulær billeddannelse.
I en nylig undersøgelse, Richard W. Taylor og kolleger på de tværfaglige afdelinger for fysik og biologi i Tyskland udviklede en ny billedbehandlingstilgang for at overvinde denne vanskelighed. De brugte metoden til at spore den transmembrane epidermale vækstfaktorreceptor (EGFR) med nanometerskalapræcision i tre dimensioner (3-D). Teknikken tillod billeddannelse på tværs af mikrosekunder til minutter. Forskerne gav eksempler på bevægelse og indeslutning i nanoskala ved hjælp af metoden til at afbilde allestedsnærværende processer såsom diffusion i plasmamembraner, transport i filopodia og rotationsbevægelse under endocytose. Resultaterne er nu offentliggjort i Natur fotonik .
Mens støt fremgang i fluorescensmikroskopi har gjort det muligt for forskere at overvåge cellulære begivenheder i nanometerskala, der mangler stadig at blive opnået meget med avancerede billeddannelsessystemer. Udfordringerne ved fluorescensmikroskopi opstod på grund af den endelige emissionshastighed af en fluorescerende kilde (farvestofmolekyle eller halvlederkvanteprik), hvor for få fotonemissioner i løbet af en meget lille tidsramme forhindrede effektiv eller langvarig billeddannelse. Den centrale vanskelighed ved spredningsbaseret mikroskopi er i forhold til den nanoskopiske sonde, som konkurrerer mod baggrundsstøj og et lavt signal-til-støj-forhold (SNR); at begrænse billedbehandlingens potentiale til kun et par nanometer i eksperimenter med højhastighedssporing.

Rå video af en epidermal vækstfaktor-guld-nanopartikel (EGFR-GNP), der diffunderer på en HeLa-cellemembran. Kredit: Natur fotonik , doi:10.1038/s41566-019-0414-6
I nærværende arbejde, Taylor et al. brugte interferometrisk spredning (iSCAT) mikroskopi til at spore protein i levende cellemembraner. Metoden kunne visualisere sonde-celle-interaktioner for at forstå dynamikken mellem diffusion og lokal topologi. Under forsøgene, forskerne brugte guldnanopartikler (GNP'er) til at mærke epidermale vækstfaktorreceptorer (EGFR'er) i HeLa-celler. EGFR'erne er type I transmembrane proteiner, der kan føle og reagere på ekstracellulære signaler, hvis afvigende signalering er forbundet med en række sygdomme. Taylor et al. viste det BNP-mærkede protein som en 'nano-rover', der kortlagde nano-topologien af cellulære funktioner såsom membranterrasser, filopodia og clathrin strukturer. De gav eksempler på subdiffusion og nanoskopisk indeslutningsbevægelse af et protein i 3D ved høj tidsopløsning og lange tidspunkter.
I forsøgene, Taylor et al. introducerede de epidermale vækstfaktor-guld nanopartikel (EGF-GNP)-prober til prøvekammeret i mikroskopet ved hjælp af en mikropipette til at mærke EGFR'erne (epidermal vækstfaktor-receptorer) på HeLa-celler og verificerede, at proberne stimulerede EGFR'erne. Tidligere undersøgelser havde allerede vist, at sondestørrelsen kunne påvirke lipiddiffusionen i syntetiske membraner, selvom de ikke påvirkede diffusionsmåden. Derudover i levende celler, molekylær crowding var ubetydelig for partikler lig med eller mindre end 50 nm.
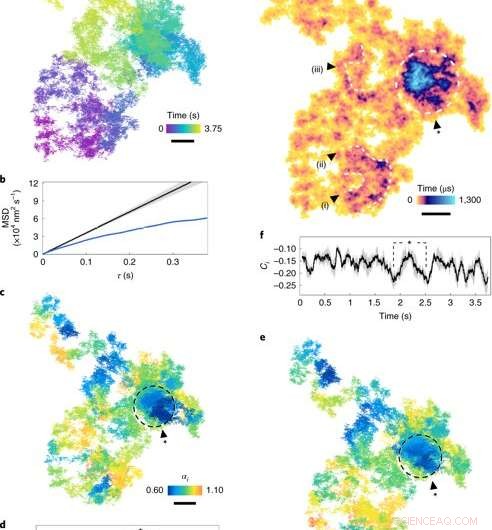
Diffusion på plasmamembranen. (en), En lateral diffusionsbane (17,5 μs eksponeringstid, se farveskala for kronologi). (b), MSD (middel kvadratisk forskydning) versus τ. Den blå kurve viser MSD for a. Den sorte kurve simuleres normal diffusion (α =1), med den grå konvolut, der indikerer usikkerheden. (c), Diffusionseksponenten for rullende vinduer (farveskala) over banen. Områder med subdiffusion (α<1) er angivet med mørkere nuancer. (d), αi gennem tiden. Den grå skygge repræsenterer en gennemsnitlig usikkerhed på 7 ± 4 %, svarende til et 95% konfidensinterval for et vindue på 100 ms (1, 000 billeder) og τ= 250 μs. Punkterne markeret med stjernen svarer til cirklen i c. (e), Trinretning Ci til rullende vinduer langs banen. (f), Trinretningen Ci plottet gennem tiden, med skraveringen angiver usikkerhed. (g), ATOM -besættelsesgrund med opholdstid (farveskala). Beholderstørrelsen svarer til lokaliseringsfejlen. Bemærkelsesværdige områder med udvidet besættelse, markeret som sløjfer og hvirvler (i) - (iii), er tegn på vedvarende nanoskopiske strukturer. Den lukkede region repræsenterer en tæt plet af bemærkelsesværdig subdiffusion. Målestænger, 100 nm. Kredit: Natur fotonik , doi:10.1038/s41566-019-0414-6
Taylor et al. verificeret disse to konkrete tilfælde i dette arbejde ved at sammenligne BNP'er med varierende diametre ved 48 nm og 20 nm. Forskerne gennemførte derefter fluorescerende og biokemiske undersøgelser for at foreslå, at de EGF-belagte BNP aktiverede EGFR-signalering, meget gerne de frit tilgængelige EGF'er, hvilket indikerer, at mærket ikke hindrede biologiske funktioner. For at overvinde baggrundsstøj i forbindelse med molekylær billeddannelse implementerede forskerne en ny algoritme, som udtrak den fulde iSCAT-punktspredningsfunktion (iSCAT-PSF) direkte fra hver ramme for klarhed. Da eksisterende teknikker ikke er i stand til at visualisere funktioner ved høj rumlig og tidsmæssig opløsning, mange detaljer om intracellulær aktivitet er stadig et spørgsmål om debat. Som svar, den nye metode af Taylor et al. tilbød et væld af dynamiske heterogeniteter i 3D for at kaste lys over intracellulær proteinbevægelse.
Forskerne undersøgte først kvantitativt subdiffusion i plasmamembranen ved at overveje et 2-D eksempel på EGFR-rejsen på membranen af en levende HeLa-celle. For det, de beregnede den gennemsnitlige firkantforskydning (MSD) for hele bevægelsesbanen. Taylor et al. behøvede ikke at foretage antagelser om arten af diffusion eller dets geografiske landskab under beregningen. De målte forekomsten af biologiske diffraktive barrierer og indespærringer ved at observere graden af retningskorrelation mellem to vektorielle trin på tværs af et tidsrum.

Spredning på et filopodium. Kredit: Natur fotonik , doi:10.1038/s41566-019-0414-6
Forskerne vurderede derefter populariteten af hver banepixel i rummet ved at introducere et akkumuleret temporal occupancy map (ATOM). I denne teknik, de inddelte banens laterale plan i nanometer-store bins og talte forekomsten af partiklen i hver bin. Resultaterne indikerede arrangementet af nanostrukturer i sløjfer og hvirvler inden for en minimal levetid på 250 nanosekunder (5000 billeder) for potentielt at skildre et præ-endocytisk trin. I alt, de simulerede observationer viste, hvordan proteindiffusion blev påvirket af cellens understruktur.
ISCAT -mikroskopiteknikken tillod forskere at registrere effekter i en meget lang periode, som de brugte sammen med 3D-billeddannelsesfunktioner til at følge EGFR'er på et filopodium. Filopodia er biologisk stavlignende cellulære fremspring indeholdende bundter af aktinfilamenter med en diameter på op til 100 til 300 nm og en længde på 100 µm. Nanostrukturer kan fornemme mekaniske stimuli til kemoattraktion eller frastødning i det cellulære mikromiljø, samtidig med at de giver steder til celleadhæsion. Ligandbinding og EFGR -aktivering på filopodia forekom ved lave koncentrationer af EGF, efterfulgt af dets association med actinfilamenter og retrograd transport af EFGR til cellelegemet.
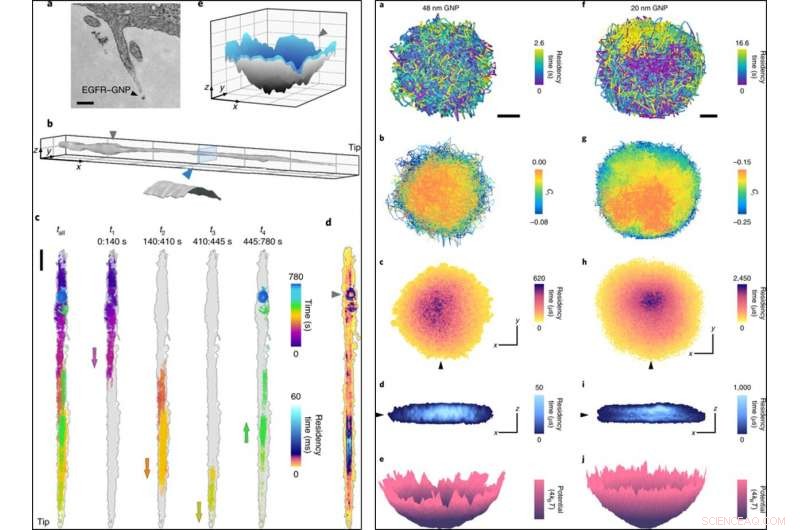
VENSTRE:(a) Et TEM -billede (transmissionselektronmikroskop) af et filopodium inklusive et EGFR -BNP. (b), En filopodiumoverflade rekonstrueret fra 780, 000 banepunkter med en lokaliseringsfejl på σx, y = 2 nm optaget ved 1, 000 fps. Indsat, tværsnitsskive, der viser en cylindrisk overflade med en diameter på 150 nm efter at have taget højde for størrelsen af BNP. (c), En rå 13 min bane (til venstre) brudt i fire efterfølgende stykker, der afslører rejsen til og fra spidsen, med pile, der markerer netbevægelsens retning. (d), Et ATOM -plot på c, korrigeret for filopodiumdrift. (e), En overfladeinterpolation fra de sidste 80 s. Den ringlignende indespærring i slutfasen (markeret med en trekant) er en 3D-pit. Skalabjælkerne er 200 nm (a), 1 μm (x, y) og 200 nm (z) (b), 1, 000 nm (c) og 100 nm (x, y) og 50 nm (z) (e). HØJRE:(a), En lateral bane af en 48 nm GNP -probe. Målestok, 100 nm. En lavere tidsmæssig prøveudtagning af denne indespærring ville have undervurderet omfanget af afgrænsning. (b), Ci for banen (ved at bruge en tidsforsinkelse på fem billeder), som viser delvist hindret diffusion med tilbøjelighed til friere diffusion i midten. (c), Et ATOM -plot af en. (d), Et snit gennem 3D-ATOM-plottet langs linjen i den sorte trekant i c viser, at belægning favoriserer et inderste disklignende område. Akserne angiver 100 nm i både c og d. (e), Konvertering af den tidsmæssige 2D-besættelse fra c til en effektiv potentiel energifordeling. (f–j), Svarende til a–e, men for en 20 nm GNP -probe. Kredit: Natur fotonik , doi:10.1038/s41566-019-0414-6
Forskerne fik således indsigt i de nanoskopiske detaljer ved diffusion langs filopodium og registrerede dataene over 13 minutter. De analyserede 3D-banen for at skabe filopodium-topografien ved hjælp af guldnanopartikler som en 'nano-rover' og kortlagde overfladetopologien af cellulære strukturer til en dybere undersøgelse. De plottede banen ATOM (akkumuleret kort for tidsbelægning) og fandt ud af, at 3D-repræsentationen var i overensstemmelse med det biologiske trin med præ-endocytisk membraninvasion.
Højhastighedsmikroskopiteknikker såsom iSCAT er nødvendige for at opnå tidsoplysninger i høj opløsning og forhindre sløring af effekter under nanopartikellokaliseringsbaseret billeddannelse. Forskerne demonstrerede denne funktion ved at registrere begrænset diffusion ved 30, 000 fps (billeder pr. sekund) med 48 nm og 20 nm BNP'er. De fulgte eksperimenterne med ultrahøjhastigheds 3D-sporing af proteiner ved 66, 000 fps ved hjælp af en kort eksponeringstid på 10 µs inden for en tidsvarighed på 3,5 sekunder. Hurtig iSCAT-mikroskopi-billeddannelse gav yderligere bevis for at afsløre de indviklede træk ved endocytiske hændelser i forhold til clathrin-medieret endocytose i HeLa-celler, når de blev simuleret af lave koncentrationer af EGF.
På denne måde, Taylor et al. bemærkede, at den nye teknik trofast kunne registrere nano-topografiske oplysninger. Resultaterne matchede observationerne optaget med transmissionselektronmikroskopi (TEM) uden signifikante forskelle på probestørrelsesreduktion fra 48 nm til 20 nm, og samtidig give ny indsigt. Den nye indsigt omfattede detaljer om subdiffusion, nanoskopisk indespærring, 3-D konturer af filopodia og clathrin strukturer på nanoskala. Forskerne agter at kombinere iSCAT med in situ superopløselig fluorescensmikroskopi for at forstå proteinernes baner, vira og andre nanoskopiske biologiske enheder. Taylor et al. sigter mod at fremme metoderne til billedanalyse for at spore BNP mindre end 20 nm i fremtiden og tror på, at den nye teknologi og yderligere optimering vil give dem mulighed for specifikt at forstå virusses livscyklus uden at bruge en ekstern etiket til sporing.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Kosmologer et skridt tættere på at forstå kvantegravitationDr. Vincent Vennin. Kredit:University of Portsmouth Kosmologer, der forsøger at forstå, hvordan man forener de to søjler i moderne videnskab – kvantefysik og tyngdekraft – har fundet en ny måde at
Kosmologer et skridt tættere på at forstå kvantegravitationDr. Vincent Vennin. Kredit:University of Portsmouth Kosmologer, der forsøger at forstå, hvordan man forener de to søjler i moderne videnskab – kvantefysik og tyngdekraft – har fundet en ny måde at -
 Begynd at lære datavidenskab med denne 85 timers træningDataanalyse bliver mere og mere populært, fordi de samme grundlæggende principper kan anvendes til forskellige industrier. Dette gør det til et af de mest lovende felter at bryde ind i. Uanset om d
Begynd at lære datavidenskab med denne 85 timers træningDataanalyse bliver mere og mere populært, fordi de samme grundlæggende principper kan anvendes til forskellige industrier. Dette gør det til et af de mest lovende felter at bryde ind i. Uanset om d -
 Beregninger af tandhjulforholdDen nemmeste måde at beregne tandhjulforhold på er at tælle antallet af tænder på både de drivende og de drevne tandhjul og dele den første med den anden. Dette forhold viser, hvor mange gange det
Beregninger af tandhjulforholdDen nemmeste måde at beregne tandhjulforhold på er at tælle antallet af tænder på både de drivende og de drevne tandhjul og dele den første med den anden. Dette forhold viser, hvor mange gange det -
 Unik bølgetank hjælper forskere med at forstå truslen om useriøse havbølgerKredit:University of East Anglia Et team af forskere fra Australien, Belgien, Italien og Storbritannien har demonstreret, hvordan havvind kan generere spontane skurkbølger, det første skridt til a
Unik bølgetank hjælper forskere med at forstå truslen om useriøse havbølgerKredit:University of East Anglia Et team af forskere fra Australien, Belgien, Italien og Storbritannien har demonstreret, hvordan havvind kan generere spontane skurkbølger, det første skridt til a


