En multimodal ny objektivfri mikroskopiteknologi til medicinske anvendelser

Kredit:ChipScope.eu
Dagens avancerede analyse af biologiske prøver ved lysmikroskopi omfatter en bred vifte af teknikker lige fra konventionel lysfeltmikroskopi og fasekontrastmikroskopi til højopløsnings konfokal laserscanningsmikroskopi og til nyligt udviklede superopløsningsmikroskopiteknikker som stimuleret emissionsudtømning (STED) eller stokastisk optisk rekonstruktionsmikroskopi (STORM), som ophæver Abbes grænse for diffraktion.
På trods af tilgængeligheden af disse sofistikerede, super opløsningsteknikker, reproducerbar visualisering af celler og identifikation af subcellulære strukturer i biologiske prøver kræver stadig farvning med farvestoffer eller immunmærkning med antistoffer mod specifikke cellulære antigener.
Generelt, in vitro-observation af levende celler kan give værdifuld indsigt i deres struktur og dynamik, herunder organellernes organisering og transduktion af kemiske signaler involveret i celle-celle- og celle-matrix-interaktioner. Desværre, der er en begrænset anvendelse til langsigtet in vitro-billeddannelse, da de fleste højopløsningsmikroskopiteknologier kræver behandlet/fikseret væv eller celler. Da både optisk mikroskopi med høj opløsning og fluorescensbilleddannelse normalt kræver meget dygtige brugere, dyrt udstyr og vedligeholdelse, den præsenterede nye digitale in-line holografiske mikroskopi (DIHM) in vitro billedbehandlingsteknologi åbner et stort område af applikationer for standardbrugere. Dette analytiske optiske system giver hurtige og reproducerbare resultater til lave omkostninger. I øvrigt, det annullerer nødvendigheden af henvisning til specialiserede laboratorier og er let implementeret som et diagnostisk værktøj for læger (almen praktiserende læger og specialister).
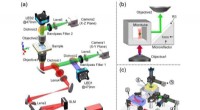
DIHM er baseret på den numeriske rekonstruktion af et digitalt registreret hologram. Det giver mulighed for erhvervelse af begge, amplitude- og faseinformationen af en bølgefront formet af den mikroskopiske prøve. Fordelen ved DIHM ligger i enkelheden ved opsætningen:mikroskopet består af en lysemitterende diode (LED) som en belysningskilde, passende filtrering til sammenhængsforbedring og en billedsensor. Den omfattende databehandlingsalgoritme transformerer de optagede hologrammer til et mikroskopbillede ved vinkelspektrumtilgang og digital filtrering. Generelt, opløsningen af et sådant mikroskop er stærkt påvirket af den rumlige kohærenslængde af belysningen, som kan forbedres ved at reducere emissionsområdet, enten ved at skære en del af bølgefronten med pinhullet eller ved hjælp af en punktlignende nanoLED. De nanoLED-arrays, der er udviklet inden for EU's Horizon 2020-program ChipScope-projektet, vil tillade forbedring af billedopløsningen, der er kompatibel med den konventionelle optiske mikroskopi.
Linseløst DIHM mikroskop
Denne kendsgerning gør linseløs mikroskopi til et ideelt værktøj til medicinsk diagnose i fjerntliggende områder, da det ikke er nødvendigt for lægen at bringe og vedligeholde store, tunge og følsomme analyseudstyr. En simpel bærbar computer og en kuffertstørrelse linseløs mikroskopsamling er nok til - for eksempel - at stille en parasitdiagnose ud fra kropsvæskeprøver (f.eks. Malaria, Amøbe osv.). Den robuste konstruktion muliggør en hurtig, pålidelig og automatiseret analyse af prøven ved at kombinere ikke kun lysmikroskopi med høj opløsning, men også ved at implementere moderne analyseteknikker baseret på påvisning af ændringer i humant DNA, identifikation af virale genomer og immunologisk karakterisering i én enhed.
For at give den højeste lysfølsomhed og optiske opløsning, systemet er udstyret med et normalt gråtonekamera til at fungere i en multi-celle billeddannelseslysfelttilstand. Dette nye linseløse mikroskop er udstyret med et mikrofluidisk flowkanalsystem til håndtering af levende celler og billeddannelse.
Sidste artikelOverfladefunktionaliseret mikrokavitet øger ikke -lineær optik
Næste artikelMatematik afslører ny indsigt i Marangoni-strømme
 Varme artikler
Varme artikler
-
 Fysikere undersøger en ny opskrift på opvarmning af plasmaDet indre af Alcator C-Mod tokamak, hvor der blev udført forsøg, der har været med til at skabe et nyt scenario til opvarmning af plasma og opnåelse af fusion. Kredit:Bob Mumgaard/Plasma Science and F
Fysikere undersøger en ny opskrift på opvarmning af plasmaDet indre af Alcator C-Mod tokamak, hvor der blev udført forsøg, der har været med til at skabe et nyt scenario til opvarmning af plasma og opnåelse af fusion. Kredit:Bob Mumgaard/Plasma Science and F -
 Samtidig optisk fangst og billeddannelse i det aksiale plan for lys-stof-interaktionSkematisk af den samtidige optiske fangst og fluorescerende billeddannelse i det aksiale plan. Kredit:XIOPM Optisk fangst er blevet et stærkt værktøj inden for mange områder som biologi, fysik, ke
Samtidig optisk fangst og billeddannelse i det aksiale plan for lys-stof-interaktionSkematisk af den samtidige optiske fangst og fluorescerende billeddannelse i det aksiale plan. Kredit:XIOPM Optisk fangst er blevet et stærkt værktøj inden for mange områder som biologi, fysik, ke -
 Løsning af et mysterium:En ny model til at forstå, hvordan visse kerner splittesDa kernen bliver opdelt i to fragmenter, det gennemgår deformationer, der skal redegøres præcist for i modeller for at kunne foretage præcise forudsigelser. Kredit: Videnskabelige rapporter Forsk
Løsning af et mysterium:En ny model til at forstå, hvordan visse kerner splittesDa kernen bliver opdelt i to fragmenter, det gennemgår deformationer, der skal redegøres præcist for i modeller for at kunne foretage præcise forudsigelser. Kredit: Videnskabelige rapporter Forsk -
 Opbevaring af information i antiferromagnetiske materialerDe mikroskopiske momenter i antiferromagnetiske materialer har vekslende orientering, i modsætning til ferromagneternes. Kredit:Lorenzo Baldrati, JGU Forskere ved Mainz University har vist, at inf
Opbevaring af information i antiferromagnetiske materialerDe mikroskopiske momenter i antiferromagnetiske materialer har vekslende orientering, i modsætning til ferromagneternes. Kredit:Lorenzo Baldrati, JGU Forskere ved Mainz University har vist, at inf
- Øget sikkerhed for børn omkring plæneklippere
- Nedbrydelige elektroniske komponenter fremstillet af majsstivelse
- Modeller designet til at forudsige, hvornår og hvordan vejene i Bizkaia vil forringes
- Kan biologisk nedbrydelige forurenende stoffer forårsage miljøproblemer?
- Forandrende resultater skubber 3D-print til den molekylære grænse
- Udforskning af forholdet mellem to-kroppen og kollektivet


