Udforsker bittesmå kræfter med enkelt molekyle kraftspektroskopi
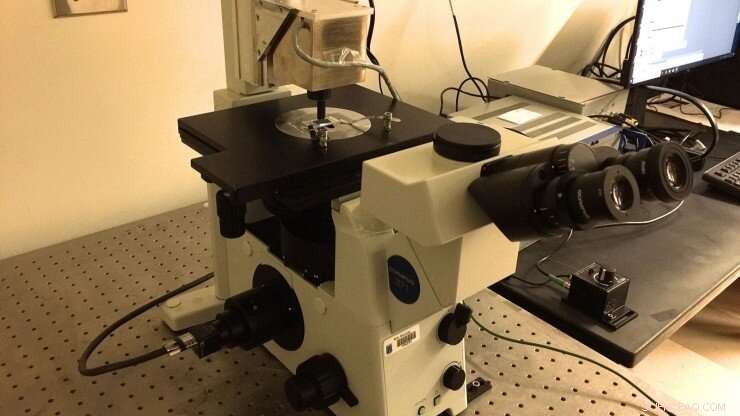
Marszalek-laboratoriets nye magnetiske pincet-opsætning, som blev bygget i henhold til specifikationer delt af professor Julio Fernandez (Columbia University). Et mikrofluidisk kammer funktionaliseret med polyprotein-"børster" afbildes ved hjælp af et immersionsolieobjektiv, der føres til et CMOS-kamera. Magnetiske perler er knyttet til polyproteiner for at udøve piconewton-kræfter på dem ved at justere positionen af permanente neodym 52-magneter. Magneterne manipuleres ved hjælp af PID-enhed placeret over kammeret. Kredit:Duke University
Med hensyn til rumorganisation, DNA har kræfter, der konkurrerer med Marie Kondo. En DNA-streng, der er to meter lang, folder sig indviklet sammen til en cellekerne, der kun er 10 mikrometer på tværs. (Et af hårene på dit hoved har en diameter på 100 mikron, og du kan ikke se noget mindre end det uden et mikroskop.) Alt, hvad der skal ske biokemisk, for at DNA'et kan fungere, afhænger af den præcise udpakning og afvikling af dets strenge fra det lille rum.
Men studiet af DNA og andre komplekse molekyler fokuserer ofte ikke på deres mekaniske egenskaber, men på deres kemiske processer, bemærkede Duke maskinteknik og materialevidenskab professor Piotr Marszalek. Mens biokemisk forskning har ført til banebrydende applikationer som kloning, genterapi og genekspressionsprofilering, Marszalek sagde, at det intense fokus på det enkelte område nogle gange har overskygget mekanikkens betydning for at forstå forholdet mellem molekylær struktur og funktion.
Marszalek tilhører et fællesskab af forskere, der bruger enkeltmolekylekraftspektroskopi (SMFS) til at studere molekylær struktur, og de kræfter, der stabiliserer disse strukturer. I øjeblikket, der er tre hovedtilgange til SMFS:atomkraftmikroskopi (AFM), som scanner overfladen af et molekyle med en sonde på størrelse med nogle få atomer og er i stand til mekanisk at strække disse molekyler; optisk pincet, som tiltrækker partikler via fokuserede lasere (og som gav deres opfinder, Arthur Ashkin, en Nobelpris i fysik); og magnetisk pincet, hvis træk er så kraftigt, at Marszalek advarede mig mod at håndtere dem, af frygt for, at min hud ville blive klemt mellem de magnetiske cylindre, og jeg ville finde dem umulige at lirke fra hinanden.
Hver tilgang gør det muligt for forskere at fange et enkelt molekyle - som DNA, eller en smule muskel eller andet protein – og stræk det langsomt ud for at observere, hvad der sker.
Det knækker ikke bare på midten, som du kunne forvente.
Polypeptidkæder er foldet lokalt, Marszalek forklarede, på en måde, der danner små kugler. "Når du først strækker et protein, du laver en lige struktur, " sagde han. "Men når du trækker længere, alt begynder at slappe af. Du kan trække og trække uden at gå i stykker, og i ekstreme tilfælde kan et domæne optrevle og tilbyde ekstra længde for at beskytte sig selv."
Marszalek understregede, at dette ikke er nyheder - i maj 1997, tre artikler om dette emne blev udgivet næsten samtidigt, en ind Natur (Robert Simmons' team brugte en optisk pincet) og to i Videnskab (Carlos Bustamantes team brugte også en optisk pincet, mens Herman Gaubs hold brugte AFM). Men disse opdagelser lærte forskerne meget om, hvordan muskler er bygget, og forstærke vigtigheden af at forstå mekanik i den mindste skala.
Marszalek arbejder i øjeblikket på at forstå, hvordan molekyler genvinder deres former og fungerer, når spændingen, der udøves på dem, er afslappet. Tag ildflue-luciferase - når den er korrekt foldet, dette protein bioluminescerer. Når den mister sin struktur, det bliver en simpel polymer, ude af stand til at producere lys. andre proteiner, på samme sammenbrudspunkt, drage fordel af hjælpen fra "chaperone enzymer", der hjælper med at genoprette deres oprindelige form. hvordan de gør det, Nemlig, er uklart, og at lære mere om den mekanisme kunne give indsigt i, hvordan vores kroppe heler efter fysisk stress.
Nogle af Marszaleks kollegaer arbejder på mekanikken bag bakterielle infektioner - hvordan bakterier som staph er i stand til at detektere receptorproteiner i celler og låse sig fast på dem så ihærdigt, at blodbanen ikke er i stand til at vaske dem væk. Styrken af denne binding blev målt med succes i 2017 ved hjælp af AFM, og at opdage, hvordan man opløser bindingerne, kunne hjælpe i kampen mod sådanne dødelige infektioner.
I slutningen af sommeren i 2019, National Science Foundation finansierede en SMFS-workshop, som Marszalek organiserede, sammen med University of Texas Medical Branch's Andres F. Oberhauser. Afholdt på Duke, workshoppen samlede de armaturer, der var banebrydende for SMFS-teknikker for årtier siden, med yngre forskere, der fokuserede på fremtidsudsigter for kraftspektroskopi. Den intense dagsorden med sessioner og rundborde varede til langt ud på aftentimerne hver dag, da deltagerne dækkede de vigtigste præstationer, som hver teknik muliggjorde, foreslåede fremtidige retninger, og overvejede vejspærringer, der hindrer yderligere fremskridt.
Det var også, som Marszalek havde håbet, et byttemøde for værktøjer og ideer. Forskere ved University of Colorado-Boulder tilbød molekyler, der kan bruges som "håndtag" til at trække andre molekyler fra hinanden; en forsker fra Johns Hopkins demonstrerede, hvordan laserpincet kan bruges til at fange frisksyntetiserede proteiner. Marszalek selv gik væk med et skinnende nyt samarbejde med University of Milwaukee, hvis fysikere har dyb ekspertise med magnetiske pincet.
"Enkeltmolekylekraftspektroskopi er tydeligvis blevet myndig og produceret mange afgørende opdagelser inden for mekanobiologi og mekanokemi, " sagde Marszalek. "Begejstringen omkring SMFS-tilgange er støt stigende, men der er udfordringer, der skal løses, især når det kommer til at udnytte SMFS til at studere mekaniske egenskaber og kræfter inde i levende celler. Efterhånden som forskere udvikler smarte tilgange til at nå dette mål, dette emne alene kunne være et tema for et andet spændende symposium."
Sidste artikelRekordstor terahertz laserstråle
Næste artikelNy optisk teknik fanger dynamikken i realtid af cementbinding
 Varme artikler
Varme artikler
-
 Hvilket aldrig før set radioaktivt henfald kunne fortælle os om neutrinoerColorado State University fysikprofessor Bill Fairbank med sit laboratoriums enkeltatom-billeddannelsesapparat. Kredit:John Eisele/Colorado State University Bill Fairbank leder efter ... ingenting
Hvilket aldrig før set radioaktivt henfald kunne fortælle os om neutrinoerColorado State University fysikprofessor Bill Fairbank med sit laboratoriums enkeltatom-billeddannelsesapparat. Kredit:John Eisele/Colorado State University Bill Fairbank leder efter ... ingenting -
 Løsning af komplekse fysikproblemer med lynets hastFysikere har udviklet en ny metode, der muliggør emulering af komplekse beregninger med lynets hast. Dette kunne give ny indsigt om kvanteegenskaberne af stærkt interagerende stof såsom atomkerner og
Løsning af komplekse fysikproblemer med lynets hastFysikere har udviklet en ny metode, der muliggør emulering af komplekse beregninger med lynets hast. Dette kunne give ny indsigt om kvanteegenskaberne af stærkt interagerende stof såsom atomkerner og -
 Kosmiske stråler kan have efterladt et uudsletteligt aftryk i det tidlige liv, siger fysikereByger af partikler med høj energi, der stammer fra solen og vores galakse, kolliderer med nitrogen og ilt i den øvre atmosfære. På jordoverfladen, brusebadet domineres af magnetisk polariserede muoner
Kosmiske stråler kan have efterladt et uudsletteligt aftryk i det tidlige liv, siger fysikereByger af partikler med høj energi, der stammer fra solen og vores galakse, kolliderer med nitrogen og ilt i den øvre atmosfære. På jordoverfladen, brusebadet domineres af magnetisk polariserede muoner -
 Undersøgelse af dynamikken i demokratiske valg ved hjælp af fysikkteoriUSA har gennemgået en overgang fra stabile til ustabile valg, vist ved polarisering af USAs demokratiske og republikanske partis platforme mellem 1944 og 2016. Denne overgang er drevet af stigende væl
Undersøgelse af dynamikken i demokratiske valg ved hjælp af fysikkteoriUSA har gennemgået en overgang fra stabile til ustabile valg, vist ved polarisering af USAs demokratiske og republikanske partis platforme mellem 1944 og 2016. Denne overgang er drevet af stigende væl
- Internationalt projekt har til formål at sekventere det arktiske oceans DNA
- Påvisning af små mængder virus ved tidlige infektioner
- Genskabelse af gamle mineraler
- Vi har gjort fremskridt med at dæmme op for globale emissioner, men det er en brøkdel af hvad der …
- Google opbygger genopretningsafdeling for digitale zombier
- Undersøgelse:Millennials arresteret oftere end forgængere - selv når der begås færre forbrydels…


