Eksponentiel skalering af friktionskræfter i celler

En polymer sammensat af et protein tubulin, det er en komponent i cytoskeletet involveret i intracellulær transport, cellulær mobilitet og nuklear division. Kredit:AMOLF
AMOLF -forskere har præsenteret en teori, der beskriver friktionen mellem biologiske filamenter, der er tværbundet af proteiner. Overraskende nok, deres teori forudsiger, at friktionskraften skaleres meget ulineært med antallet af tværbindere. Forfatterne mener, at celler bruger denne skalering ikke kun til at stabilisere cellulære strukturer, men også for at kontrollere deres størrelse. De nye fund er vigtige for forståelsen af dynamikken i cellulære strukturer, såsom den mitotiske spindel, som trækker kromosomer fra hinanden under celledeling.
Motoriske proteiner kontra friktionskræfter
Mange cellulære strukturer består af lange filamenter, der er tværbundet af motoriske proteiner og ikke-motoriske proteiner (se figur). Disse såkaldte cytoskeletale strukturer giver ikke kun celler deres mekaniske stabilitet, men også sætte dem i stand til at kravle over overflader og til at trække kromosom fra hinanden under celledeling. Kraftgenerering tilskrives typisk motoriske proteiner, hvilken, ved hjælp af kemisk brændstof, kan flytte filamenterne i forhold til hinanden. Imidlertid, disse motorkræfter modsættes friktionskræfter, der genereres af passive, ikke-motoriske proteiner. Disse friktionskræfter er en central determinant for de mekaniske egenskaber ved cytoskeletale strukturer, og de begrænser hastigheden og effektiviteten, hvormed disse strukturer dannes. I øvrigt, de kan endda være afgørende for deres stabilitet, fordi hvis motorkræfterne ikke modsættes af friktionskræfterne, der genereres af de passive tværbindere, strukturerne kan endda falde fra hinanden.
Eksponentiel stigning
For at forstå dynamikken i disse cytoskeletale strukturer og de kræfter, de kan generere, det er vigtigt at forstå, hvordan friktionskræfterne skaleres med filamenternes længde og antallet af tværbindere mellem dem. Eksisterende teorier forudsiger, at friktion stiger lineært med antallet af tværbindere, hvilket er hvad man intuitivt ville forvente. Imidlertid, nylige eksperimenter har levende vist, at friktionskræfterne skaleres ikke-lineært, dvs. eksponentielt, med antallet af tværbindere. På grund af COVID-19-krisen, vi ved alle, hvilken dramatisk forskel en eksponentiel versus en lineær stigning kan gøre. Indtil nu, oprindelsen til denne yderst usædvanlige eksponentielle skaleringsadfærd for friktionen mellem filamenter blev ikke forstået.
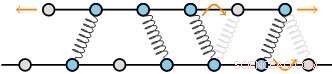
Cytoskeletale strukturer består af filamenter, der er tværbundet af proteiner. Disse filamenter består af et regelmæssigt gitter af underenheder, som giver et diskret sæt bindingssteder for tværbinderne. Forfatternes teori forudsiger, at som resultat, friktionskræfterne skaleres meget hurtigt, når antallet af tværbindere stiger. Kredit:AMOLF
Forklaring
AMOLF -gruppeleder Ten Wolde og ph.d. studerende Wierenga har nu udviklet en teori, der forklarer disse eksperimentelle observationer. Deres teori er baseret på observationen af, at biologiske filamenter består af et regelmæssigt gitter af underenheder, hvilket giver et diskret sæt bindingssteder for tværbinderne. Ten Wolde og Wierenga forudsiger, at filamenterne kun kan bevæge sig, hvis linkerne reorganiserer sig kollektivt. Som et resultat af denne kollektive reorganisering, friktionskræfterne stiger meget hurtigt, dvs. eksponentielt, med antallet af linkere.
Forfatternes arbejde har store konsekvenser for vores forståelse af dynamikken i cytoskeletale strukturer. I særdeleshed, den eksponentielle skalering betyder, at disse strukturer i det væsentlige fryser, når tværbindingstætheden overstiger en vis tærskel; friktionskræfterne bliver så høje, at de forbyder yderligere bevægelse. Celler kan bruge denne stærke skalering til at kontrollere størrelsen og stabiliteten af cellulære strukturer.
 Varme artikler
Varme artikler
-
 Sådan konverteres 1 gram til literBåde gram og liter er fælles måleenheder. Et gram er en masseenhed, der er lig med omkring en papirclips, mens en liter er en volumenhed og er en almindelig tildeling af væsker såsom drikkevarer el
Sådan konverteres 1 gram til literBåde gram og liter er fælles måleenheder. Et gram er en masseenhed, der er lig med omkring en papirclips, mens en liter er en volumenhed og er en almindelig tildeling af væsker såsom drikkevarer el -
 Lavpris, fleksibel terahertz-strålingskilde til hurtig og ikke-invasiv screeningHoldets billige THz-strålekilder, som kan drives af en laveffektlaser, præsentere lovende anvendelser inden for spektroskopi, sikkerhedsovervågning, kræftdiagnose, billeddannelse og kommunikation. Kre
Lavpris, fleksibel terahertz-strålingskilde til hurtig og ikke-invasiv screeningHoldets billige THz-strålekilder, som kan drives af en laveffektlaser, præsentere lovende anvendelser inden for spektroskopi, sikkerhedsovervågning, kræftdiagnose, billeddannelse og kommunikation. Kre -
 Energieffektivt superledende kabel til fremtidige teknologierVed hjælp af en ny proces, tynde bånd af barium-kobberoxid af sjælden jord bearbejdes til superlederkabler med høj temperatur med høj strømførende kapacitet. Kredit:ITEP, KIT Til tilslutning af vi
Energieffektivt superledende kabel til fremtidige teknologierVed hjælp af en ny proces, tynde bånd af barium-kobberoxid af sjælden jord bearbejdes til superlederkabler med høj temperatur med høj strømførende kapacitet. Kredit:ITEP, KIT Til tilslutning af vi -
 Fysikere kommer tættere på at undersøge de symmetrier, der ligger til grund for vores universEn ukendt molekylær ion er afbildet i en fælde med to radiumioner. Radiumionernes fluorescens giver en måling af mysterieionens masse, identificerer det som RaOCH 3+ via metoden introduceret af Fan
Fysikere kommer tættere på at undersøge de symmetrier, der ligger til grund for vores universEn ukendt molekylær ion er afbildet i en fælde med to radiumioner. Radiumionernes fluorescens giver en måling af mysterieionens masse, identificerer det som RaOCH 3+ via metoden introduceret af Fan
- Centralafrikas første astronomiske observatorium i forskningsklasse nogensinde rykker et skridt næ…
- Facebook siger, at kinesiske telefonproducenter fik adgang til data (opdatering)
- Seksualundervisning i Ghanas skoler:Nogle svar på hvornår og hvad
- Grøn jul:Alpine skisportssteder overvejer en fremtid uden sne
- Isdække tager en dyb dukkert på Great Lakes
- Nyt syn på solen:To missioner vil gå tættere på vores stjerne end nogensinde før


