Laser forbedrer tidsopløsningen for CryoEM
Grafisk abstrakt. Kredit:DOI:10.1016/j.cplett.2021.138812
I 2017, Jacques Dubochet, Joachim Frank, og Richard Henderson vandt Nobelprisen i kemi for deres bidrag til kryo-elektronmikroskopi (cryoEM), en billeddannelsesteknik, der kan fange billeder af biomolekyler som proteiner med atompræcision.
I cryoEM, prøver er indlejret i glaslegeme, en glaslignende form for is, der opnås, når vand fryses så hurtigt, at krystallisering ikke kan forekomme. Med prøven forglasset, billeder i høj opløsning af deres molekylære struktur kan tages med et elektronmikroskop, et instrument, der danner billeder ved hjælp af en elektronstråle i stedet for lys.
CryoEM har åbnet nye dimensioner inden for biovidenskab, kemi, og medicin. For eksempel, det blev for nylig brugt til at kortlægge strukturen af SARS-CoV-2 spike-proteinet, hvilket er målet for mange af COVID-19-vaccinerne.
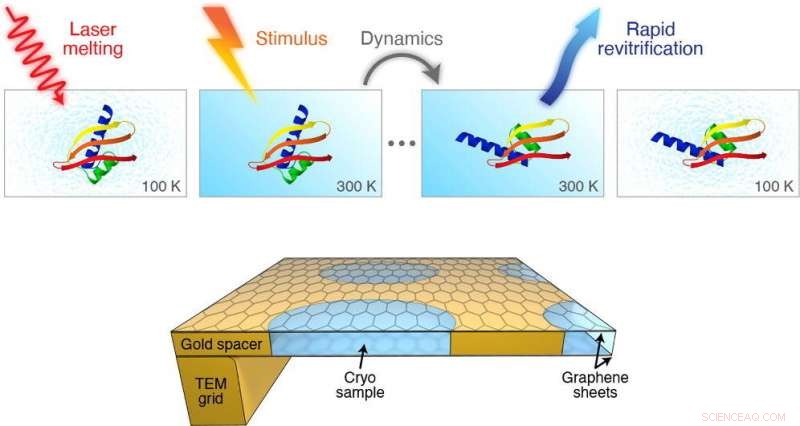
Proteiner ændrer konstant deres 3D -struktur i cellen. Disse konformationelle omlejringer er en integreret del af proteiner til at udføre deres specialiserede funktioner, og finder sted inden for milliontedele til tusindedele af et sekund. Sådanne hurtige bevægelser er for hurtige til at blive observeret i realtid ved hjælp af aktuelle cryoEM -protokoller, gør vores forståelse af proteiner ufuldstændige.
Men et team af forskere ledet af Ulrich Lorenz ved EPFL's School of Basic Sciences har udviklet en cryoEM -metode, der kan fange billeder af proteinbevægelser på mikrosekund (en milliontedel af et sekund) tidsskala. Værket er udgivet i Chemical Physics Letters.
Metoden involverer hurtig smeltning af den forglasede prøve med en laserpuls. Når isen smelter til en væske, der er et indstilleligt tidsvindue, hvor proteinet kan induceres til at bevæge sig på den måde, de gør i deres naturlige flydende tilstand i cellen.
 Varme artikler
Varme artikler
-
 Former lys med en SmartlensSkematisk illustration af placeringen med Smartlens er placeret i det optiske instrument (i dette tilfælde et mikroskop). Kredit:ICFO/ Marc Montagut Kameraydeevne på mobile enheder har vist sig at
Former lys med en SmartlensSkematisk illustration af placeringen med Smartlens er placeret i det optiske instrument (i dette tilfælde et mikroskop). Kredit:ICFO/ Marc Montagut Kameraydeevne på mobile enheder har vist sig at -
 Slowmotion -bølger af hoppende gener i det menneskelige genomFysikerne Nigel Goldenfeld (venstre) og Chi Xue, ved Carl R. Woese Institute for Genomic Biology ved University of Illinois i Urbana-Champaign. Kredit:Kathryn Faith. Naturen er fuld af parasitter
Slowmotion -bølger af hoppende gener i det menneskelige genomFysikerne Nigel Goldenfeld (venstre) og Chi Xue, ved Carl R. Woese Institute for Genomic Biology ved University of Illinois i Urbana-Champaign. Kredit:Kathryn Faith. Naturen er fuld af parasitter -
 Revolutionært kvantegennembrud baner vejen for sikrere onlinekommunikationNetværket i drift. Figuren viser modtagehardwaren for alle 8 brugere. Kredit:Siddarth K. Joshi Verden er et skridt tættere på at have et fuldstændig sikkert internet og et svar på den voksende tru
Revolutionært kvantegennembrud baner vejen for sikrere onlinekommunikationNetværket i drift. Figuren viser modtagehardwaren for alle 8 brugere. Kredit:Siddarth K. Joshi Verden er et skridt tættere på at have et fuldstændig sikkert internet og et svar på den voksende tru -
 Hvorfor kogende dråber kan løb over varme olieagtige overfladerForskere har fastslået, hvorfor dråber drives frem over en opvarmet olieagtig overflade 100 gange hurtigere end på bare metal. På billedet er forskellige fotografier af dråberne, der hjælper med at af
Hvorfor kogende dråber kan løb over varme olieagtige overfladerForskere har fastslået, hvorfor dråber drives frem over en opvarmet olieagtig overflade 100 gange hurtigere end på bare metal. På billedet er forskellige fotografier af dråberne, der hjælper med at af
- Sådan beregnes gasforløb i en Pipe
- Brug af netværk til at forstå vævsspecifik genregulering
- I klassisk og kvantesikker kommunikation er praktisk tilfældighed ufuldstændig
- Jupiter, Saturn smelter sammen på nattehimlen, nærmest i århundreder
- Nanopartikler erstatter nål og tråd
- ATLAS rapporterer første observation af WWW-produktion


