Klæbepunktet:Hvorfor fysikere stadig kæmper for at forstå isens evne til at klæbe og blive glat
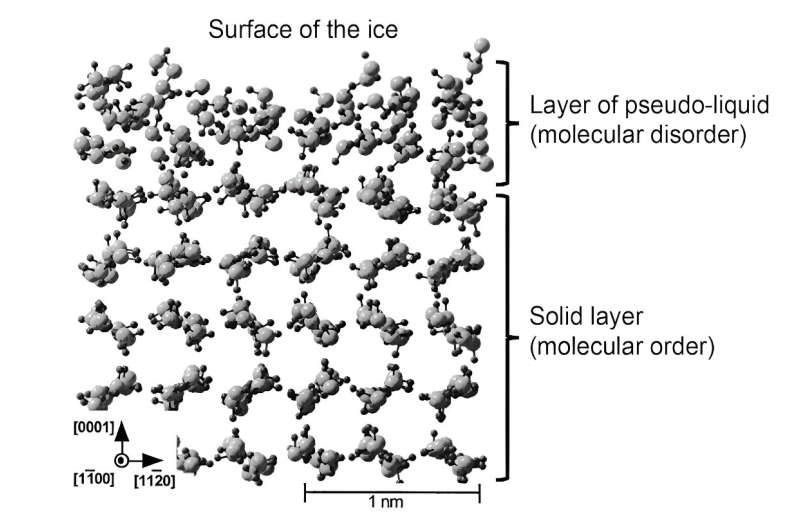
Uanset om det er i form af frost eller en glat, gennemsigtig isterning, klæber is spontant og endda ret kraftigt til mange faste overflader. Men som enhver uforsigtig person, der er skredet på et vinterfortov, kan vidne om, kan is også være meget glat. Faktisk kan is både være klistret og glat.
Denne alsidighed har længe undret videnskabsmænd. Til at begynde med har de forsøgt at knække hemmeligheden bag isens glathed i mere end 150 år. Blandt dem har været berømte fysikere som Lord Kelvin og Michael Faraday. Sidstnævnte, bedre kendt for sit arbejde inden for elektromagnetisme, var den første til at forestille sig tilstedeværelsen af et tyndt lag flydende vand, der dækker is, selv et godt stykke under 0°C. På det tidspunkt ræsonnerede han, at kontakten af en fast genstand mod overfladelaget fik det til at fungere som et smøremiddel, hvilket i høj grad reducerede friktionen på isen. Eksistensen af dette væskelag blev bekræftet af eksperimenter mere end et århundrede senere.
En glat sag
For at besvare spørgsmålet "Hvorfor er is glat?" vi skal først forstå, hvordan dette tynde lag flydende vand på den frosne overflade er blevet til.
Da vand er tættere i sin flydende fase end i dets iskolde tilstand, har man længe troet, at smeltningen af isoverfladen var forbundet med overtryk - for eksempel på grund af skaterens vægt på det lille overfladeareal, der lå under hende eller hans skøjter. Ved at komprimere isen yderligere ville skateren få den til at smelte, hvilket gør den flydende og glat.
Andre mener, at varme frigives ved friktion, når objektet bevæger sig over isen, hvilket får overfladen til at smelte. På samme måde som når du gnider dine hænder sammen for at varme dem, når du gnider et fast stof mod et andet, bliver de varme op.
Disse to mekanismer forklarer dog ikke, hvorfor isen forbliver glat under -20°C. Ved sådanne temperaturer ville det kræve et betydeligt tryk - omkring 500 gange det, en skøjte udøver - for at få den til at smelte.
I 1960'erne, mere end et århundrede efter Faraday, blev J.W. Telford og J.S. Turner trak langsomt en ledning gennem "kold" is (under -20°C) for at afsløre, at den forblev glat ned til -35°C, hvorefter den varme frigivet ved friktion ikke længere var tilstrækkelig til at smelte isen.
Det var kun omkring et århundrede efter Faradays intuition, at vi var i stand til at demonstrere dette væskelag indirekte ved at måle egenskaberne af isens overflade og ikke volumenet - i dette tilfælde dens egenskaber for absorption af kulbrintedampe, som er ret sammenlignelige med egenskaberne for isens overflade. flydende vand!
Teknikker, der involverer proton- eller røntgenspredning, som normalt bruges til at studere krystallers struktur, har gjort det muligt at estimere tykkelsen til mellem et og flere hundrede nanometer. Nogle undersøgelser har endda antydet, at denne tykkelse afviger, når temperaturen nærmer sig 0°C.
For nylig har simuleringer gjort det muligt bedre at repræsentere strukturen af dette væskelag. Efterfølgende blev dette lag omtalt som "pseudo-væske" eller "kvasi-væske" for at differentiere det fra den sande væskefase. Et sådant teoretisk arbejde har vist, at i dette overfladelag er molekylerne i stand til at bevæge sig mere frit, hvilket bekræfter deres rolle som smøremiddel. Ikke desto mindre er den molekylære struktur ikke helt den samme som flydende vand, hvilket har konsekvenser for de mekaniske egenskaber af dette pseudo-flydende lag.
En nylig undersøgelse viste en stærk sammenhæng mellem molekylernes individuelle mobilitet og den makroskopiske friktionskoefficient (jo lavere koefficient, jo lettere er det at glide), hvilket tyder på, at det ikke så meget er tykkelsen af laget, der har betydning for glidning. men derimod den individuelle bevægelse af molekylerne. Minimumsværdien af friktionskoefficienten er målt til -7°C, kendt som den optimale temperatur for skiløbere og skatere.
Anden forskning gik til hjertet af pseudo-væskelaget ved hjælp af en nano-probe, spidsen af et atomkraftmikroskop. Ved at vibrere denne spids forbundet med en ekstremt præcis kraftsensor og måle friktionen mellem spidsen og væsken i laget, målte forfatterne, at denne væske kan være 50 gange mere tyktflydende end flydende vand, og at den også besidder elasticitet (en egenskab). mere forbundet med den faste tilstand). Denne viskositet svarer til dine spiseoliers, hvilket gør det pseudo-flydende lag til et fremragende smøremiddel.
For at opsummere:is glider, fordi der dannes et væskelag på omkring 1 til 100 nanometer tykt på dens overflade. Dets mekaniske egenskaber (viskositet, elasticitet), som er forskellige fra flydende vands, og mobiliteten af molekylerne, der udgør det, som er meget større end fast is, giver det dets exceptionelle smørende egenskaber.
Hvorfor klæber is?
Isens klæbrighed fortsætter dog med at forvirre videnskabsmænd, på trods af 70 års eksperimenter. Under sidstnævnte har forskere haft en tendens til at gøre brug af et ret simpelt sæt:et stempel forbundet til kraftsensoren skubber en isblok, selv klæbet til en fast genstand. Når isterningen bryder væk, bliver kraften registreret af sensoren pludselig nul, og den maksimale værdi før dette brud måles. Men disse resultater har vist nogle gange modstridende tendenser og en ret bred spredning.
En nylig gennemgang af emnet konkluderede, at isens adhæsionskraft "ikke kun afhænger af den kemiske sammensætning, overfladeruhed, mekaniske og termiske egenskaber af substratet [men] afhænger også kritisk af temperaturen og endda af den eksperimentelle anordning til måling af vedhæftning ."
For at være lidt mere præcis, når vi udforsker litteraturen om emnet over de sidste 60 år, bemærker vi, at styrken, hvormed is klæber til et fast stof, afhænger stærkt af temperaturen i et område mellem -20°C og 0°C ( is klæber hårdere til et koldere fast stof). Hvad angår overfladeruhedens rolle, er den ambivalent:for nogle faste stoffer (især metaller) klæber is stærkere til et mere ru substrat, hvorimod det på nogle plastik er omvendt...
Endelig, på et kemisk niveau, kan flydende vand muligvis spredes bedre ud på nogle overflader end andre. For eksempel spredes vand meget godt på rent glas, mens nogle overflader er hydrofobe, såsom teflon.
En nylig undersøgelse har vist, at jo mere vand i dets flydende tilstand spreder sig over overfladen af et fast stof, jo mere is vil klæbe til dette faste stof. Omvendt vil en overflade med ringe affinitet til flydende vand også have ringe vedhæftning til is.
Hvorfor dette forhold mellem spredning af vand og vedhæftning af is? For det første, for at is kan klæbe til et koldt fast stof, skal vand i flydende tilstand have været i stand til at fryse ved kontakt med det faste stof. Her er et simpelt eksperiment, som alle kan gøre:
- Placer en metalplade i fryseren eller i din isterningbakke.
- Tag en isterning og læg den på tallerkenen uden at tage det hele ud af fryseren:det klistrer ikke.
- Tag en anden isterning og lad den smelte let ved stuetemperatur (ved at tage den ud af fryseren i et par sekunder f.eks.), og læg den derefter på den kolde tallerken. Denne gang holder det!
Hvad kan vi konkludere? Intuitivt, jo større affinitet vandet har til overfladen, desto lettere siver det flydende vand ind i ruheden og hullerne på overfladen af det faste stof, hvilket øger kontaktfladen mellem det og isen efter størkning og konsoliderer dermed vedhæftningen. Dette eksperiment demonstrerer også flydende vands rolle som klæbemiddel. Når du bruger et konventionelt klæbemiddel - for eksempel flydende lim - til at forbinde to dele sammen, er det, når delene størkner (ved fordampning af et opløsningsmiddel i limen), at den stærke, definitive vedhæftning finder sted. Det samme sker, når flydende vand afkøles ved kontakt med et koldt fast stof og størkner. Laget af frosset vand spiller så rollen som et af de faste stoffer.
Hvordan kan isen gøres mindre klæbende?
Vi kan ikke forklare isadhæsion i detaljer, men vi kan forsøge at reducere dens styrke. Idéen med at bruge vandafvisende behandlinger er naturligt opstået, men disse behandlinger er ikke særlig robuste over tid og kan have den modsatte effekt af, hvad der var tiltænkt. Mere lovende løsninger involverer at sprede et tyndt lag olie eller en hydrogel over overfladen, men der er stadig problemer med stabiliteten af disse lag over store områder.
En anden tilgang er at bruge aktive afisningsmetoder. En sådan teknik er overflade-ultralyd, som genererer "mikrojordskælv" på den faste overflade og kan få isen til at bryde væk. Vi studerer i øjeblikket denne metode i MSC-laboratoriet.
Leveret af The Conversation
Denne artikel er genudgivet fra The Conversation under en Creative Commons-licens. Læs den originale artikel. 
 Varme artikler
Varme artikler
-
 Metal Organic Framework (MOF) mikrokrystaller til flerfarvet bredbåndslasingSkematisk over enakset homøpitaksial vækst af ZJU-68 krystaller. Den organiske brodannende ligand H2CPQC giver en højere chelateringsstedtæthed langs krystalaksens retning, og den signifikante forskel
Metal Organic Framework (MOF) mikrokrystaller til flerfarvet bredbåndslasingSkematisk over enakset homøpitaksial vækst af ZJU-68 krystaller. Den organiske brodannende ligand H2CPQC giver en højere chelateringsstedtæthed langs krystalaksens retning, og den signifikante forskel -
 Første direkte observation af dødkegleeffekten i partikelfysikEn charmekvark (c) i et partonbruser mister energi ved at udsende stråling i form af gluoner (g). Bruseren viser en død kegle af undertrykt stråling omkring kvarken for vinkler, der er mindre end forh
Første direkte observation af dødkegleeffekten i partikelfysikEn charmekvark (c) i et partonbruser mister energi ved at udsende stråling i form af gluoner (g). Bruseren viser en død kegle af undertrykt stråling omkring kvarken for vinkler, der er mindre end forh -
 Lys-infunderede partikler går langt i organiske halvledereKredit:Pixabay/CC0 Public Domain Polaritons tilbyder det bedste fra to meget forskellige verdener. Disse hybridpartikler kombinerer lys og molekyler af organisk materiale, hvilket gør dem til ideel
Lys-infunderede partikler går langt i organiske halvledereKredit:Pixabay/CC0 Public Domain Polaritons tilbyder det bedste fra to meget forskellige verdener. Disse hybridpartikler kombinerer lys og molekyler af organisk materiale, hvilket gør dem til ideel -
 Fysikere ser elektronhvirvler for første gangKredit:Pixabay/CC0 Public Domain Selvom de er diskrete partikler, flyder vandmolekyler kollektivt som væsker og producerer strømme, bølger, boblebade og andre klassiske væskefænomener. Ikke sådan
Fysikere ser elektronhvirvler for første gangKredit:Pixabay/CC0 Public Domain Selvom de er diskrete partikler, flyder vandmolekyler kollektivt som væsker og producerer strømme, bølger, boblebade og andre klassiske væskefænomener. Ikke sådan
- Tørke og økosystemer bestemmes af samspillet mellem to klimafænomener
- Søgningen efter elektronhulsvæsker bliver varmere
- Hvordan forenkler du din skråning
- Enzymatisk photocaging til undersøgelse af genregulering gennem DNA-methylering
- Forbedret forudsigelse af pesticidrester
- Rusland, USA skyder efter månen med fælles månestationsprojekt (opdatering)


