Bryder lokal symmetri - hvorfor vand fryser, men silica danner et glas
Silica, på den anden side, er et kovalent netværk fast stof. Det betyder, at siliciumatomerne i silica er kovalent bundet til hinanden og danner en stærk, stiv struktur. Der er ingen svage intermolekylære kræfter mellem silicamolekyler, så silica danner ikke en krystallinsk struktur, når den afkøles. I stedet danner det et glas, som er et ikke-krystallinsk fast stof.
Forskellen i den måde, vand og silica fryser på, skyldes de forskellige typer af intermolekylære kræfter, der er til stede i hvert materiale. De stærke hydrogenbindinger mellem vandmolekyler tillader vand at danne en krystallinsk struktur, mens manglen på stærke intermolekylære kræfter mellem silicamolekyler forhindrer silica i at danne en krystallinsk struktur.
 Varme artikler
Varme artikler
-
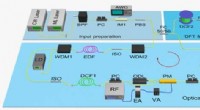 Realtidsobservation af frekvenser Bloch-oscillationer med fiber loop-moduleringCW Laser, kontinuerlig bølge laser; ML Laser, mode-låst laser; BPF, båndpasfilter; PC, polarisering controller; AWG, vilkårlig bølgeformgenerering; JEG ER, intensitetsmodulator; PBS, polarisationsstrå
Realtidsobservation af frekvenser Bloch-oscillationer med fiber loop-moduleringCW Laser, kontinuerlig bølge laser; ML Laser, mode-låst laser; BPF, båndpasfilter; PC, polarisering controller; AWG, vilkårlig bølgeformgenerering; JEG ER, intensitetsmodulator; PBS, polarisationsstrå -
 Teori forklarer ferromagnetisk superlederadfærdKredit:@tsarcyanide/MIPT Press Office Forskere fra Frankrig og Rusland har tilbudt en teoretisk forklaring på opførslen af et nyligt opdaget materiale, der kombinerer superledende og ferromagnet
Teori forklarer ferromagnetisk superlederadfærdKredit:@tsarcyanide/MIPT Press Office Forskere fra Frankrig og Rusland har tilbudt en teoretisk forklaring på opførslen af et nyligt opdaget materiale, der kombinerer superledende og ferromagnet -
 En model forklarer effekter som dannelsen af skyer fra havetDrop udkastning. Kredit:University of Sevilla / Shutterstock Alle væsker indeholder altid gasser i en større eller mindre koncentration afhængig af det tryk og den temperatur, den udsættes for. Di
En model forklarer effekter som dannelsen af skyer fra havetDrop udkastning. Kredit:University of Sevilla / Shutterstock Alle væsker indeholder altid gasser i en større eller mindre koncentration afhængig af det tryk og den temperatur, den udsættes for. Di -
 Mikroskopisk trampolin kan hjælpe med at skabe netværk af kvantecomputereDenne chip, designet af forskere ved JILA og måler mindre end en halv tomme, konverterer mikrobølgeenergi til laserlys. Kredit:Peter Burns og Dan Schmidt Tag et spring:En mikroskopisk trampolin ka
Mikroskopisk trampolin kan hjælpe med at skabe netværk af kvantecomputereDenne chip, designet af forskere ved JILA og måler mindre end en halv tomme, konverterer mikrobølgeenergi til laserlys. Kredit:Peter Burns og Dan Schmidt Tag et spring:En mikroskopisk trampolin ka
- Sådan laver du en 3D-model af en Atom
- Forskere, der studerer træringe, ser klimaændringsspor
- Fem niveauer af biosfæren
- Tibets eksilmuslimer viser forviklinger af kultur, identitet for flygtninge
- Ikke-flygtig kvantehukommelse:Discovery peger vej til flash-lignende hukommelse til lagring af qubit…
- Hvordan Auroras virker


