Er der struktur i glasuorden?
I glas er atomer eller molekyler arrangeret i små, gentagne enheder kaldet "klynger" eller "domæner". Disse klynger er typisk sammensat af nogle få til et par dusin atomer eller molekyler og har en specifik, ordnet struktur. Selve klyngerne kan være arrangeret på en tilfældig måde, men den interne struktur i hver klynge er veldefineret.
Tilstedeværelsen af kort rækkevidde i glas er ansvarlig for mange af dets unikke egenskaber, såsom dets gennemsigtighed, styrke og hårdhed. Manglen på lang rækkefølge forhindrer på den anden side glas i at danne et regulært krystalgitter, hvilket resulterer i dets amorfe natur.
Her er nogle eksempler på kort rækkevidde i forskellige typer glas:
1. Silicaglas (Kvarts):Silicaglas, der primært består af siliciumdioxid (SiO2), har en kortrækkende orden karakteriseret ved tetraedriske arrangementer af oxygenatomer omkring siliciumatomer. Disse tetraedre er forbundet til at danne et kontinuerligt netværk, hvilket giver silicaglas sin stærke og stive struktur.
2. Metalliske glas:Metalliske glas, dannet af hurtigt afkøling af smeltede metaller, udviser kort rækkefølge i form af klynger af atomer eller icosaeder. Disse klynger er arrangeret på en uordnet måde, hvilket resulterer i den amorfe struktur af metalliske glas.
3. Polymerglas:Polymerglas, såsom polystyren eller polymethylmethacrylat (PMMA), har kort rækkefølge på grund af det regelmæssige arrangement af polymerkæder. Polymerkæderne danner sammenfiltrede netværk, hvilket resulterer i materialets solide og glasagtige natur.
Samlet set bidrager tilstedeværelsen af kortrækkende orden i glasuorden til materialets egenskaber og adfærd, mens fraværet af langrækkende orden adskiller glas fra krystallinske faste stoffer.
Sidste artikelHvordan en foton bliver til fire ladningsbærere
Næste artikelHvordan partikler pakker sig i et begrænset rum
 Varme artikler
Varme artikler
-
 Enkelt fotonemitter tager et skridt tættere på kvanteteknologiEnkeltfotonemission fra en selvsamlet GaN/AlN kvanteprik. Kredit:J. Stachurski (EPFL) For at komme tættere på kvanteteknologi er vi nødt til at udvikle ikke-klassiske lyskilder, der kan udsende en
Enkelt fotonemitter tager et skridt tættere på kvanteteknologiEnkeltfotonemission fra en selvsamlet GaN/AlN kvanteprik. Kredit:J. Stachurski (EPFL) For at komme tættere på kvanteteknologi er vi nødt til at udvikle ikke-klassiske lyskilder, der kan udsende en -
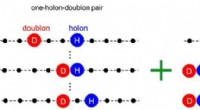 Ladningsmodel til beregning af foto-exciterede tilstande af endimensionelle Mott-isolatorerSkematisk diagram af ladningsmodellen. Effekten af elektron-elektron-interaktioner er integreret ved at tilføje multiple-holon-doublon-par basistilstande (højre) til en-holon-doublon basistilstande
Ladningsmodel til beregning af foto-exciterede tilstande af endimensionelle Mott-isolatorerSkematisk diagram af ladningsmodellen. Effekten af elektron-elektron-interaktioner er integreret ved at tilføje multiple-holon-doublon-par basistilstande (højre) til en-holon-doublon basistilstande -
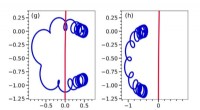 Stærke magnetfelter ændrer, hvordan friktion fungerer i plasmaDisse billeder viser banerne for en elektron i plasmaet (blå) og en ion (rød), der passerer gennem plasmaet. I (g), elektronen starter til højre for ionens vej, hvorimod i (h) det starter til venstre.
Stærke magnetfelter ændrer, hvordan friktion fungerer i plasmaDisse billeder viser banerne for en elektron i plasmaet (blå) og en ion (rød), der passerer gennem plasmaet. I (g), elektronen starter til højre for ionens vej, hvorimod i (h) det starter til venstre. -
 Forskere opdager elektronækvivalenter i kolloide systemerArgonne-forskere har brugt små partikler som elektronækvivalenter til at skabe metallisk adfærd i kolloide systemer, der primært består af større partikler. Disse små partikler kunne fungere som budbr
Forskere opdager elektronækvivalenter i kolloide systemerArgonne-forskere har brugt små partikler som elektronækvivalenter til at skabe metallisk adfærd i kolloide systemer, der primært består af større partikler. Disse små partikler kunne fungere som budbr
- Når et glas vand efterlades ude i solen gradvist forsvinder det kemiske forandring?
- Egenskaber af hydrater til kemieksperimenter
- Hvad er et patent egentlig?
- Undersøgelse afslører høje niveauer af tidligere uanede forurenende stoffer i hjem, miljø
- Flint, Michigan bly krise burde have begravet byen i vandflasker. Så hvorfor gjorde det ikke?
- Forskere bruger hele levende celler som skabeloner til at søge efter bioaktive molekyler


