Hvilken information giver det andet kvantetal af en elektron?
1. Orbital form:
Det andet kvantetal (l) bestemmer formen på elektronens orbital. Hver værdi af l svarer til en specifik orbitalform:
- l =0:s orbital (sfærisk form)
- l =1:p orbital (tre håndvægtformede orbitaler orienteret langs x-, y- og z-akserne)
- l =2:d orbital (fem komplekse orbitaler med forskellige former, inklusive kløverblads- og håndvægtsformer)
- l =3:f orbitaler (syv endnu mere komplekse orbitaler)
2. Subshells:
Elektroner med samme hovedkvantetal (n) og samme l-værdi siges at tilhøre den samme underskal. For eksempel, inden for n =2 energiniveauet svarer l =0 underskal til 2s orbitalen, mens l =1 underskal svarer til de tre 2p orbitaler (2px , 2py , 2pz ).
3. Energiunderniveauer:
Det andet kvantetal påvirker også elektronens energi i en underskal. Elektroner med højere l-værdier (højere vinkelmomentum) har generelt højere energiniveauer inden for den samme underskal. Det betyder, at f.eks. 2p orbitaler har lidt højere energi end 2s orbitaler i n =2 energiniveauet.
4. Elektronkapacitet:
Det maksimale antal elektroner, der kan optage en underskal, bestemmes af det andet kvantetal. Formlen 2(2l + 1) giver det maksimale antal elektroner for en given l-værdi:
- l =0:s underskal kan maksimalt rumme 2 elektroner (2(2(0) + 1) =2)
- l =1:p subshell kan maksimalt rumme 6 elektroner (2(2(1) + 1) =6)
- l =2:d subshell kan maksimalt rumme 10 elektroner (2(2(2) + 1) =10)
Sammenfattende beskriver det andet kvantetal (l) formen af elektronorbitaler, bestemmer underskaller, påvirker elektronenerginiveauer inden for underskaller og angiver det maksimale antal elektroner, der kan optage hver underskal. At forstå det andet kvantetal hjælper med at visualisere elektronfordelinger, forklare atomare strukturer og forudsige elektronadfærd i forskellige atomer og molekyler.
Sidste artikelHvorfor er dipolmomentet af bf3 nul?
Næste artikelEn temperatur på 200 F svarer til cirka hvad Celsius?
 Varme artikler
Varme artikler
-
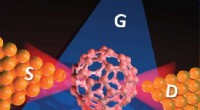 Terahertz-spektroskopi går ind i enkeltmolekylregimetIllustration af en enkeltmolekylær transistor (SMT) med en bowtie -antennestruktur. S, D, og G angiver kilden, dræne, og gateelektroder i SMT, henholdsvis. Et enkelt molekyle fanges i den skabte nanog
Terahertz-spektroskopi går ind i enkeltmolekylregimetIllustration af en enkeltmolekylær transistor (SMT) med en bowtie -antennestruktur. S, D, og G angiver kilden, dræne, og gateelektroder i SMT, henholdsvis. Et enkelt molekyle fanges i den skabte nanog -
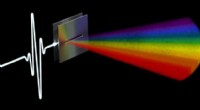 Forskere løser linkopdagelsesproblem for terahertz-datanetværkStråling af varierende frekvenser udgår fra en utæt bølgeleder i forskellige vinkler. Denne regnbue af frekvenser er grundlaget for et linkopdagelsessystem til fremtidige terahertz-datanetværk. Kredit
Forskere løser linkopdagelsesproblem for terahertz-datanetværkStråling af varierende frekvenser udgår fra en utæt bølgeleder i forskellige vinkler. Denne regnbue af frekvenser er grundlaget for et linkopdagelsessystem til fremtidige terahertz-datanetværk. Kredit -
 Naturens mindste regnbuer, skabt af påfugleedderkopper, kan inspirere til ny optisk teknologiEn miniature påfugleedderkop med regnbue-iriserende. a) En voksen han Maratus robinsoni. b) A M. robinsoni hviler på en menneskelig fingernegl:edderkoppen er kun ~? 2,5? mm stor. Edderkoppens iriser
Naturens mindste regnbuer, skabt af påfugleedderkopper, kan inspirere til ny optisk teknologiEn miniature påfugleedderkop med regnbue-iriserende. a) En voksen han Maratus robinsoni. b) A M. robinsoni hviler på en menneskelig fingernegl:edderkoppen er kun ~? 2,5? mm stor. Edderkoppens iriser -
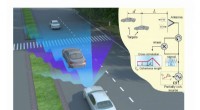 Radarteknologi med lav båndbredde giver forbedret detektering af objekterDelvis sammenhængende radardriftsskemaer. Kredit: Naturkommunikation . Radarteknologier blev oprindeligt designet til at identificere og spore luftbårne militære mål. I dag bruges de oftere til a
Radarteknologi med lav båndbredde giver forbedret detektering af objekterDelvis sammenhængende radardriftsskemaer. Kredit: Naturkommunikation . Radarteknologier blev oprindeligt designet til at identificere og spore luftbårne militære mål. I dag bruges de oftere til a
- Hvordan sexarbejde er blevet påvirket af pandemien
- Mønter viser, at Herodes kun byggede en del af Andet Tempels mure
- Fundamental effekt af superlederfysik observeret 30 år efter, at den blev forudsagt
- State-of-the-art computerkode kan fremme indsatsen for at udnytte fusionsenergi
- Det amerikanske agentur undersøger, hvordan man kan opdage udbrud af algeopblomstring
- Fremstilling af langlivede positroniumatomer til antimateriale-tyngdekraftforsøg


