Hvorfor er dipolmomentet af bf3 nul?
For at forstå dette mere klart, overvej følgende:
1. Polar obligationer :B-F-bindingerne i BF3 er polære, hvor fluoratomerne har en delvis negativ ladning og boratomet har en delvis positiv ladning. Dette skyldes, at fluor er mere elektronegativt end bor.
2. Symmetrisk arrangement :De tre B-F-bindinger er arrangeret på en symmetrisk måde og danner en ligesidet trekant. Det betyder, at dipolmomenterne for de enkelte B-F-bindinger peger i forskellige retninger og ophæver hinanden.
3. Vektorsum :Netto dipolmomentet for et molekyle er vektorsummen af dipolmomenterne af dets individuelle bindinger. I tilfælde af BF3 summeres dipolmomenterne af de tre B-F-bindinger op til nul, hvilket resulterer i et samlet dipolmoment på nul.
Derfor, på grund af det symmetriske arrangement af de polære B-F-bindinger, ophæver dipolmomenterne af disse bindinger hinanden, hvilket resulterer i et nul-dipolmoment for BF3.
Sidste artikelHvor længe kører en E iltflaske på 2 L?
Næste artikelHvilken information giver det andet kvantetal af en elektron?
 Varme artikler
Varme artikler
-
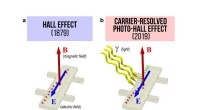 Lås op for en 140-årig hemmelighed i fysikHalvledere er de grundlæggende byggesten i digitale enheder. Forbedringer i halvlederfunktionalitet og ydeevne muliggør ligeledes næste generations applikationer af halvledere til computing, sansning
Lås op for en 140-årig hemmelighed i fysikHalvledere er de grundlæggende byggesten i digitale enheder. Forbedringer i halvlederfunktionalitet og ydeevne muliggør ligeledes næste generations applikationer af halvledere til computing, sansning -
 Forskere skaber sammenfiltrede fotoner 100 gange mere effektivt end tidligere muligtYuping Huang og hans kolleger ved Stevens Institute of Technology demonstrerede et kvantekredsløb, der let kan integreres med andre optiske komponenter, baner vejen for høj hastighed, rekonfigurerbar,
Forskere skaber sammenfiltrede fotoner 100 gange mere effektivt end tidligere muligtYuping Huang og hans kolleger ved Stevens Institute of Technology demonstrerede et kvantekredsløb, der let kan integreres med andre optiske komponenter, baner vejen for høj hastighed, rekonfigurerbar, -
 Et laboratoriums irriterende biprodukt leverer nu 2D materialeforskningEt irriterende biprodukt af Ames Laboratorys superlederforskning er faktisk et meget eftertragtet og svært tilgængeligt isolerende materiale, hBN, som videnskabsmænd, der studerer grafen og andre 2D-m
Et laboratoriums irriterende biprodukt leverer nu 2D materialeforskningEt irriterende biprodukt af Ames Laboratorys superlederforskning er faktisk et meget eftertragtet og svært tilgængeligt isolerende materiale, hBN, som videnskabsmænd, der studerer grafen og andre 2D-m -
 Ekstremt sjælden Higgs boson henfaldsproces spottetKompakt Muon Solenoid -eksperiment ved Large Hadron Collider. Kredit:CERN/CMS Higgs-bosonen nåede nattens berømmelse i 2012, da den endelig blev opdaget i et virvar af andre partikler genereret ve
Ekstremt sjælden Higgs boson henfaldsproces spottetKompakt Muon Solenoid -eksperiment ved Large Hadron Collider. Kredit:CERN/CMS Higgs-bosonen nåede nattens berømmelse i 2012, da den endelig blev opdaget i et virvar af andre partikler genereret ve
- Livet frosset i tid under et elektronmikroskop får en nobelpris
- Hvorfor er kulstof så vigtigt at organiske forbindelser?
- Hvad er mekaniske midler ved bagning?
- Hvordan skærmbaserede teknologier påvirker skoleelever
- Hvordan fungerer en højfrekvent induktionsmotor?
- Store ændringer på vej i horisonten for den globale rumindustri


