Livet frosset i tid under et elektronmikroskop får en nobelpris
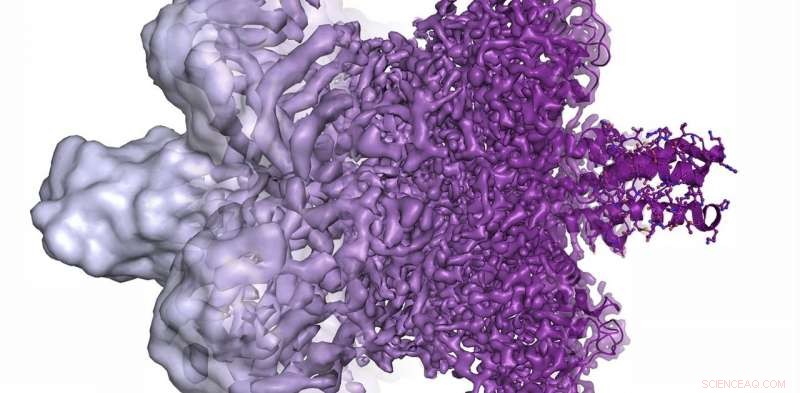
Elektronmikroskopets opløsning er radikalt forbedret i de sidste par år, fra for det meste at vise formløse klatter (venstre) i 2013 til nu at kunne visualisere proteiner ved atomopløsning (til højre) i nuet. Kredit:Martin Högbom/Det Kongelige Svenske Videnskabsakademi
Forskerne, der udviklede evnen til at se nogle af livets byggesten under elektronmikroskopet, har fået Nobelprisen i kemi 2017.
Jacques Dubochet, Joachim Frank og Richard Henderson var banebrydende for kryo-elektronmikroskopi, som Royal Swedish Academy of Sciences sagde både forenkler og forbedrer billeddannelsen af biologiske molekyler, kendt som biomolekyler.
Præmien på 9 millioner svenske kroner (A $ 1,4 millioner) fordeles ligeligt mellem Dubochet, ved Schweiz 'universitet i Lausanne, Åben, ved Columbia University i New York, og Henderson, ved MRC Laboratory of Molecular Biology, Cambridge i Storbritannien.
Akademiet sagde, at metoden udviklet af de tre forskere havde flyttet biokemi ind i en ny æra. Teknologien giver nu forskere mulighed for at generere et billede i høj opløsning af biomolekyler, mens de eksisterer i deres naturlige tilstand.
Den biologiske lås og nøgle
Menneskekroppen er forbløffende kompleks og kræver samarbejde mellem en række biokemiske mekanismer, såsom fordøjelse og energiproduktion, for at fungere godt. Disse indviklede processer involverer brug af biomolekyler, typisk store enheder fremstillet af aminosyrer - livets byggesten.
Vigtigere, ligesom opførelsen af ethvert murstensbygget hus, blokernes konfiguration eller placering er afgørende for, hvor godt vores konstruktion står op, eller hvor godt vores biomolekyler fungerer.
Desuden, biomolekyler præsenterer deres evne til at udføre opgaver ved at interagere med andre enheder, sådanne enzymer, i kroppen. Disse er baseret på en specifik konfiguration, meget ligesom hvordan kun en nøgle kan åbne en bestemt lås.
Den betydningsfulde udfordring, som det prisvindende team havde overvundet, var at udvikle kapaciteten til at observere biomolekylerne i deres naturlige tilstand. Før fremkomsten af kryo-elektronmikroskopi, de blev visualiseret med røntgenkrystallografi.
Man mente også, at elektronmikroskoper kun var egnede til billeddannelse af dødt stof, fordi den kraftige elektronstråle ødelægger biologisk materiale.
Det vigtigste gennembrud kom med udviklingen af en proces til hurtigt at fryse en prøve. Dette gjorde det muligt at fange biomolekylerne i deres skræddersyede konfiguration.
Teamet identificerede tidligt i deres arbejde, at frysning af en prøve før visualisering kan give den forbedring, der kræves for fuldt ud at forhøre biomolekylerne.
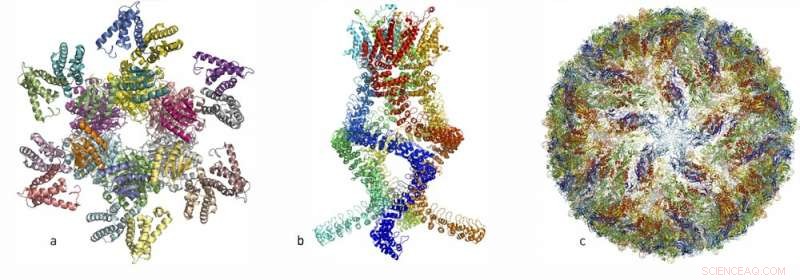
I løbet af de sidste par år har forskere har offentliggjort atomstrukturer af talrige komplicerede proteinkomplekser:(venstre, a) et proteinkompleks, der styrer døgnrytmen, (centrum, b) en sensor af den type, der læser trykændringer i øret og giver os mulighed for at høre, og (højre, c) Zika -virussen. Kredit:Det Kongelige Svenske Videnskabsakademi
Frosset i tide
Her starter det sjove. Selvom det i sig selv lyder enkelt, hurtig indefrysning af en prøve er særligt udfordrende.
Hvis processen fjerner vandet fra prøven, falder biomolekylet sammen, mister den naturlige konfiguration, forskerne ønskede. Hvis prøven fryses for langsomt, dannes der iskrystaller, som også forstyrrer biomolekylets konfiguration.
Teamet udviklede en proces kendt som forglasning. Dette fryser prøven ved -190 ℃, mens den placeres på et trådnet, en elegant enkel tilgang til løsning af et svært problem.
Ligesom de fleste nobelprisvindende videnskabelige præstationer, udviklingen var trinvis. Teamets ændringer i mange år muliggjorde kombinationen af fryseprocessen (udviklet i 1978) og mikroskopiteknologien, som først blev fuldt ud realiseret i 2013.
Denne kombination og teknologiske fremskridt muliggjorde billedbehandling i høj opløsning af biomolekyler.
Låser en virus op
Så hvad betyder alt dette? Godt, forståelse af konfigurationen af låsen gør det muligt for forskere at skære en bestemt nøgle.
Vira er store biomolekyler. Når det er visualiseret, forskere kan identificere molekyler eller udvikle farmaceutiske nøgler, der kan passe ind i deres struktur for at bryde dem fra hinanden eller forstyrre deres funktion.
Et eksempel på kraften ved kryo-elektronmikroskopi ses gennem den hurtige karakterisering af Zika-viruset kort tid efter, at det først blev identificeret som en stor global sundhedsrisiko.
Identifikationen af virusets konfiguration og lommen i biomolekylet, der slutter sig til sin vært, vil danne grundlag for igangværende undersøgelser af, hvordan denne virus bedst bekæmpes.
Teknologien har også haft indflydelse ved middagsbordet. Et amerikansk forskerhold har undersøgt varmefølende komponent i tungen, fremhæver wasabi -sensoren. Dette kan tilbyde potentialet til bedre at forstå nye metoder til smertebehandling.
I Australien, et konsortium udnytter denne teknologis magt til at undersøge sygdomme relateret til immunsystemet for at udvikle bedre behandlingsprotokoller.
Cryo-elektronmikroskopi vil være et spændende område at se i den nærmeste fremtid, både for låsesmede og videnskabsentusiaster.
Denne artikel blev oprindeligt offentliggjort på The Conversation. Læs den originale artikel. 
 Varme artikler
Varme artikler
-
 Ny syrefri magnetgenbrugsprocesKredit:Ames Laboratory En ny genbrugsproces for sjældne jordarters magneter udviklet af forskere ved Critical Materials Institute (CMI) opløser magneter i en syrefri opløsning og genvinder sjældne
Ny syrefri magnetgenbrugsprocesKredit:Ames Laboratory En ny genbrugsproces for sjældne jordarters magneter udviklet af forskere ved Critical Materials Institute (CMI) opløser magneter i en syrefri opløsning og genvinder sjældne -
 Liquid nanofoam:En game changer til fremtidige fodboldhjelmeEt elektronisk mikroskopisk billede af nanofoam -materialet. Hver pore er 10 nm i diameter. Kredit:Weiyi Lu En flydende nanofoamforing, der gennemgår test, kan forlænge sikker brug af fodboldhjelm
Liquid nanofoam:En game changer til fremtidige fodboldhjelmeEt elektronisk mikroskopisk billede af nanofoam -materialet. Hver pore er 10 nm i diameter. Kredit:Weiyi Lu En flydende nanofoamforing, der gennemgår test, kan forlænge sikker brug af fodboldhjelm -
 Lab-lavet hormon kan afsløre planters hemmelige livEn syntetisk version af auxin og dets proteinreceptor (lyseblå) lægger sig sammen, skabe et konstrueret par, der opfører sig ligesom det naturlige. Kredit:Keiko Torii/University of Washington/Howard H
Lab-lavet hormon kan afsløre planters hemmelige livEn syntetisk version af auxin og dets proteinreceptor (lyseblå) lægger sig sammen, skabe et konstrueret par, der opfører sig ligesom det naturlige. Kredit:Keiko Torii/University of Washington/Howard H -
 Samspillet mellem kemiske spejlbillederChristian Merten arbejder på Bochum Institut for Organisk Kemi II og er medlem af Cluster of Excellence Resolv. Kredit:RUB, Kramer Kemikere fra Ruhr-Universität Bochum håber at finde ud af, hvor s
Samspillet mellem kemiske spejlbillederChristian Merten arbejder på Bochum Institut for Organisk Kemi II og er medlem af Cluster of Excellence Resolv. Kredit:RUB, Kramer Kemikere fra Ruhr-Universität Bochum håber at finde ud af, hvor s
- Nanoporer gør sterilfiltrering mere pålidelig
- Hvordan afgangstider påvirker flyselskabernes konkurrence og den rolle, luftfartsmyndighederne spil…
- Sådan adskilles salt fra Water
- Et nyt stetoskop slutter sig til kampen mod antallet af børnelungebetændelse
- Skaber ringe i naturlig antibiotikasyntese
- Space Force begynder at træne sine soldater til at kæmpe... i rummet?


