Hvilken type intermolekylære kræfter forventes mellem NO2F-molekyler?
NO2F er et polært molekyle, fordi elektronegativiteten af fluor er større end for nitrogen og oxygen. Denne forskel i elektronegativitet skaber en delvis positiv ladning på nitrogenatomet og en delvis negativ ladning på fluoratomet. De partielle ladninger på nitrogen- og fluoratomerne skaber et dipolmoment, som er et mål for et molekyles polaritet.
Dipol-dipol-interaktioner opstår, når den positive ende af en dipol tiltrækkes af den negative ende af en anden dipol. Disse vekselvirkninger er svagere end hydrogenbindinger og ionbindinger, men de kan stadig have en betydelig effekt på et stofs egenskaber.
I tilfælde af NO2F forventes dipol-dipol-interaktionerne mellem molekyler at være relativt svage. Dette skyldes, at dipolmomentet for NO2F er relativt lille. Imidlertid forventes dipol-dipol-interaktionerne mellem NO2F-molekyler stadig at være stærkere end van der Waals-interaktionerne mellem ikke-polære molekyler.
 Varme artikler
Varme artikler
-
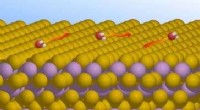 Den mystiske bevægelse af vandmolekylerSkematisk repræsentation af vandmolekylers bevægelse på en topologisk isolator. Kredit:Tamtögl Vand er allestedsnærværende og afgørende for livet. Alligevel, eksperimentel information om dens adfæ
Den mystiske bevægelse af vandmolekylerSkematisk repræsentation af vandmolekylers bevægelse på en topologisk isolator. Kredit:Tamtögl Vand er allestedsnærværende og afgørende for livet. Alligevel, eksperimentel information om dens adfæ -
 Miniaturepartikelaccelerator sparer på kontrastmidlerProf. Franz Pfeiffer og Dr. Daniela Münzel ved miniature synchrotron Munich Compact Light Source (MuCLS). Kredit:Andreas Battenberg / TUM Den mest udbredte metode til at opnå billeder af tilstoppe
Miniaturepartikelaccelerator sparer på kontrastmidlerProf. Franz Pfeiffer og Dr. Daniela Münzel ved miniature synchrotron Munich Compact Light Source (MuCLS). Kredit:Andreas Battenberg / TUM Den mest udbredte metode til at opnå billeder af tilstoppe -
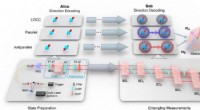 Den første kvanteorientering ved hjælp af forbedring af kvantesammenfiltrende målingerSkematisk diagram og eksperimentel opsætning for optimal orientering med parallelle og antiparallelle spins. Kredit:TANG Junfeng et al. CAS -nøglelaboratoriet for kvanteinformation, ledet af prof.
Den første kvanteorientering ved hjælp af forbedring af kvantesammenfiltrende målingerSkematisk diagram og eksperimentel opsætning for optimal orientering med parallelle og antiparallelle spins. Kredit:TANG Junfeng et al. CAS -nøglelaboratoriet for kvanteinformation, ledet af prof. -
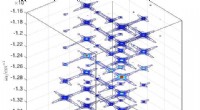 Gamers metode skaber unikke 4-D molekylære spektrale kortEt simuleret 4-D GAMERS-spektrum vist som et 3D-snit gennem en spektralakse. To dimensioner koder information om vibrationsfrekvenser, mens de resterende dimensioner repræsenterer elektroniske overgan
Gamers metode skaber unikke 4-D molekylære spektrale kortEt simuleret 4-D GAMERS-spektrum vist som et 3D-snit gennem en spektralakse. To dimensioner koder information om vibrationsfrekvenser, mens de resterende dimensioner repræsenterer elektroniske overgan
- Forskere afslører en helt ny verden af kemi ved at træde indendørs
- Undersøgelse af dyrelivskorridorer viser, hvordan de fungerer over tid
- Skæve mikrokapsler frigiver last ved lavere osmotiske tryk, der kræves til lægemiddellevering
- Hvordan bevæger drivmidlet sig, når en aerosoldåse bruges?
- Cheetah III-robot forbereder sig til en rolle som first responder
- Leder af nonprofitorganisationer for fødevaresikkerhed står i spidsen for World Food Prize


