Hvad har den største atomradius F Cl eller Cl?
Atomradius falder generelt over en periode (række) i det periodiske system fra venstre mod højre. Dette skyldes, at den effektive kerneladning (den positive nettoladning, som elektronerne i den yderste skal oplever) stiger over en periode. Den øgede effektive kerneladning trækker elektronerne tættere på kernen, hvilket resulterer i et fald i atomradius.
I tilfælde af F og Cl er F placeret på venstre side af det periodiske system i periode 2, mens Cl er placeret på højre side af det periodiske system i periode 3. Derfor har F en større atomradius end Cl.
 Varme artikler
Varme artikler
-
 Undersøgelse viser, at nikkelatsuperledere er iboende magnetiskeEn myon, i midten, snurrer som en top inden for atomgitteret af en tynd film af superledende nikkelat. Disse elementarpartikler kan fornemme det magnetiske felt, der skabes af elektronernes spins op t
Undersøgelse viser, at nikkelatsuperledere er iboende magnetiskeEn myon, i midten, snurrer som en top inden for atomgitteret af en tynd film af superledende nikkelat. Disse elementarpartikler kan fornemme det magnetiske felt, der skabes af elektronernes spins op t -
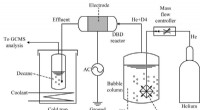 Eksperimentel plasmagenerator giver vej frem til bedre brug af lossepladsgas som energiSkematisk af den eksperimentelle opsætning af fjernelse af siloxan fra en bærergas ved anvendelse af dielektrisk barriereudladningsplasma Kredit:Malik M Tahiyat Metangas frigivet fra lossepladser
Eksperimentel plasmagenerator giver vej frem til bedre brug af lossepladsgas som energiSkematisk af den eksperimentelle opsætning af fjernelse af siloxan fra en bærergas ved anvendelse af dielektrisk barriereudladningsplasma Kredit:Malik M Tahiyat Metangas frigivet fra lossepladser -
 Stephen Hawkings kørestol, speciale til salgEn bog, og scripts af Stephen Hawking er blandt de personlige og akademiske besiddelser af Stephen Hawking på auktionshuset Christies i London, Fredag, 19. oktober kl. 2018. Online -auktionen annoncer
Stephen Hawkings kørestol, speciale til salgEn bog, og scripts af Stephen Hawking er blandt de personlige og akademiske besiddelser af Stephen Hawking på auktionshuset Christies i London, Fredag, 19. oktober kl. 2018. Online -auktionen annoncer -
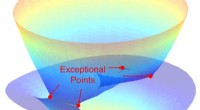 Forskere laver justerbare lys-stof-koblinger i nanorør-filmRice University-forskere brugte nanorørsfilm og polariseret lys til stærkt at koble lys og stof gradvist og efter behov ved stuetemperatur. Deres opdagelse af ekstraordinære punkter i de resulterende
Forskere laver justerbare lys-stof-koblinger i nanorør-filmRice University-forskere brugte nanorørsfilm og polariseret lys til stærkt at koble lys og stof gradvist og efter behov ved stuetemperatur. Deres opdagelse af ekstraordinære punkter i de resulterende
- Hvordan løser vi problemet med afstrømning af næringsstoffer fra landbruget?
- Solar Wind Around Pluto-instrument bekræfter, at solvinden aftager længere væk fra solen
- Sådan får du værdien af et brev i algebra 1
- Etiopisk embedsmand oplyser om flystyrtningsrapport i denne uge
- Elektroner giver modstandslag elektrisk ladning
- Fiat sælger autodeleenhed til Japans Calsonic for 6,2 mia. euro


