Hvorfor er der ingen fri rotation omkring en dobbeltbinding?
Sigma Bond Dannelse:
I en dobbeltbinding er sigma-bindingen dannet af den frontale overlapning af to \(sp^2\) hybridorbitaler fra hvert carbonatom. \(sp^2\) hybridorbitalerne er resultatet af blandingen af en \(s\) orbitaler og to \(p\) orbitaler, hvilket fører til et trigonalt plant arrangement af atomerne omkring dobbeltbindingen.
Pi-bindingsdannelse:
Pi-bindingen i en dobbeltbinding dannes af sideværts overlapning af to \(p\) orbitaler fra hvert carbonatom. Disse \(p\) orbitaler er vinkelrette på sigmabindingens plan og på hinanden. Elektrondensiteten af pi-bindingen er koncentreret over og under sigma-bindingens plan, hvilket skaber en cylindrisk elektronsky.
Stivheden af dobbeltbindingen opstår fra arten af pi-bindingen. \(p\) orbitaler involveret i pi-bindingen har en håndvægtform med elektrontæthed koncentreret i to lapper på modsatte sider af kernen. Denne form begrænser rotation omkring dobbeltbindingen, fordi ethvert forsøg på at rotere vil forstyrre overlapningen af \(p\) orbitaler og svække pi-bindingen. At bryde pi-bindingen ville kræve betydelig energitilførsel, hvilket gør rotation omkring dobbeltbindingen yderst ugunstig.
I modsætning hertil tillader enkeltbindinger dannet af overlapningen af \(sp^3\) hybridorbitaler fri rotation, fordi elektrondensiteten er fordelt mere symmetrisk omkring bindingsaksen. \(sp^3\) orbitalerne kan rotere uden væsentligt at forstyrre bindingen, hvilket giver mulighed for de forskellige konformationer af molekyler med enkeltbindinger.
Derfor spiller tilstedeværelsen af pi-bindingen og den begrænsede rotation omkring dobbeltbindingen afgørende roller ved bestemmelse af molekylær geometri, stabilitet og egenskaber af forbindelser, der indeholder dobbeltbindinger.
 Varme artikler
Varme artikler
-
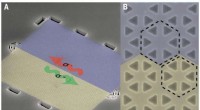 Routing fotoner med en topologisk fotonisk strukturFremstillet enhed og båndstruktur. (A) Scanning elektronmikroskop billede af enheden, som består af to regioner, der er identificeret ved blå og gul skygge, svarende til to fotoniske krystaller med fo
Routing fotoner med en topologisk fotonisk strukturFremstillet enhed og båndstruktur. (A) Scanning elektronmikroskop billede af enheden, som består af to regioner, der er identificeret ved blå og gul skygge, svarende til to fotoniske krystaller med fo -
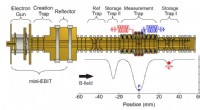 Højere præcisionsmålinger viser protonmasse mindre end antagetSkitse af opsætningen af fælden. Fældetårnet indeholder to separate opbevaringsfælder (ST-I, ST-II), målefælden (MT) og en referencefælde (RT) til magnetfeltovervågning, som i øjeblikket ikke bruges
Højere præcisionsmålinger viser protonmasse mindre end antagetSkitse af opsætningen af fælden. Fældetårnet indeholder to separate opbevaringsfælder (ST-I, ST-II), målefælden (MT) og en referencefælde (RT) til magnetfeltovervågning, som i øjeblikket ikke bruges -
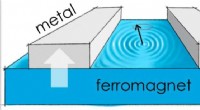 En metode til at bestemme magnonsammenhæng i solid-state-enhederKredit:Scott Bender. Et team af forskere ved Utrecht University, det norske universitet for videnskab og teknologi og universitetet i Konstanz har for nylig foreslået en ny metode til at bestemme
En metode til at bestemme magnonsammenhæng i solid-state-enhederKredit:Scott Bender. Et team af forskere ved Utrecht University, det norske universitet for videnskab og teknologi og universitetet i Konstanz har for nylig foreslået en ny metode til at bestemme -
 Nanolaminat-baseret design til UV laser spejlbelægningen, Traditionelt design ved hjælp af par af høj- og lavindeksmaterialer. b, Foreslået strategi ved brug af nanolaminatlag og materialer med lavt indeks. c, reflektans og d, transmittansspektre (45° in
Nanolaminat-baseret design til UV laser spejlbelægningen, Traditionelt design ved hjælp af par af høj- og lavindeksmaterialer. b, Foreslået strategi ved brug af nanolaminatlag og materialer med lavt indeks. c, reflektans og d, transmittansspektre (45° in


