Hvorfor afbalancerede ligninger for at støkiometri virker?
En afbalanceret ligning viser det samme antal atomer af hvert grundstof på både reaktant- og produktsiden af ligningen. Dette er vigtigt, fordi loven om bevarelse af masse siger, at stof ikke kan skabes eller ødelægges i en kemisk reaktion. Derfor, hvis ligningen ikke er afbalanceret, vil den ikke nøjagtigt repræsentere den reaktion, der finder sted.
Overvej for eksempel følgende ubalancerede ligning:
$$2H_2 + O_2 → H_2O$$
Denne ligning viser, at to molekyler brintgas reagerer med et molekyle iltgas for at producere vand. Ligningen er dog ikke afbalanceret, fordi der er fire brintatomer på reaktantsiden og kun to brintatomer på produktsiden. For at afbalancere ligningen skal vi tilføje en koefficient foran vandmolekylet:
$$2H_2 + O_2 → 2H_2O$$
Nu er ligningen afbalanceret, og den repræsenterer nøjagtigt den reaktion, der finder sted.
Ved at bruge balancerede ligninger kan vi nøjagtigt bestemme støkiometrien af en reaktion og beregne mængden af reaktanter og produkter, der er nødvendige eller producerede. Dette er vigtigt for en række anvendelser, såsom industriel kemisk produktion og laboratorieforsøg.
 Varme artikler
Varme artikler
-
 Mod adskillelsen af kvante- og klassiske forespørgselskomplekserResultatet af 2-fold og 3-fold Forreation er vist. Kredit:© Science China Press Korrelationsfunktioner bruges ofte til at kvantificere forholdet mellem indbyrdes afhængige variabler eller datasæt.
Mod adskillelsen af kvante- og klassiske forespørgselskomplekserResultatet af 2-fold og 3-fold Forreation er vist. Kredit:© Science China Press Korrelationsfunktioner bruges ofte til at kvantificere forholdet mellem indbyrdes afhængige variabler eller datasæt. -
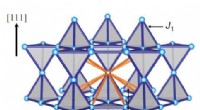 Ny indsigt i magnetiske kvanteeffekter i faste stofferModellen refererer til en kubisk krystalstruktur (pyrochlorgitter). Ikke kun var magnetiske interaktioner mellem de nærmeste naboer inkluderet, men også med de nærmeste nærmeste naboer (se tegning). K
Ny indsigt i magnetiske kvanteeffekter i faste stofferModellen refererer til en kubisk krystalstruktur (pyrochlorgitter). Ikke kun var magnetiske interaktioner mellem de nærmeste naboer inkluderet, men også med de nærmeste nærmeste naboer (se tegning). K -
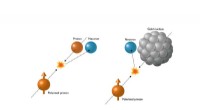 Overraskende resultat chokerer forskere, der studerer spinNeutroner, der produceres, når en spin-justeret (polariseret) proton kolliderer med en anden proton, kommer ud med en let højre-skæv præference. Men når den polariserede proton kolliderer med en meget
Overraskende resultat chokerer forskere, der studerer spinNeutroner, der produceres, når en spin-justeret (polariseret) proton kolliderer med en anden proton, kommer ud med en let højre-skæv præference. Men når den polariserede proton kolliderer med en meget -
 Tilføjelsesclip gør smartphonen til et fuldt operationelt mikroskopTilføjelsesclip gør smartphonen til et fuldt operationelt mikroskop. Kredit:CNBP Australske forskere fra ARC Center of Excellence for Nanoscale BioPhotonics (CNBP) har udviklet et 3D-printbart cli
Tilføjelsesclip gør smartphonen til et fuldt operationelt mikroskopTilføjelsesclip gør smartphonen til et fuldt operationelt mikroskop. Kredit:CNBP Australske forskere fra ARC Center of Excellence for Nanoscale BioPhotonics (CNBP) har udviklet et 3D-printbart cli
- Sydney, Melbourne advarede om at forberede sig på 50 graders dage
- Livscyklus af en påfugl
- Faktisk kulstofvalens skrevet som 1s2 2s2 2p2. hvorfor er dette ikke skrive 2s1 2p3?
- Hvordan Snapdragons holder deres farve:Skiltetrick afslører evolutionær mekanisme
- Krig mod hajer:Hvordan useriøse fiskerflåder plyndrer havets øverste rovdyr
- Bør vi være bekymrede over stigende hede i den politiske diskurs? Ja, siger eksperter


