Hvornår opstår Van Der Waals styrker?
De tre hovedtyper af Van der Waals styrker er:
- Spredningskræfter i London: Disse kræfter er de svageste af de tre typer Van der Waals-kræfter. De er forårsaget af de midlertidige udsving i elektronfordelingen af molekyler. Når elektronerne i et molekyle bevæger sig tættere på den ene side af molekylet, bliver molekylet let positivt på den ene side og lidt negativt på den anden side. Dette skaber en midlertidig dipol. Hvis et andet molekyle tilfældigvis er tæt på, kan den positive ende af dipolen tiltrække den negative ende af den anden dipol, og omvendt. Denne attraktion skaber en spredningsstyrke i London.
- Dipol-dipolkræfter: Disse kræfter opstår mellem polære molekyler. Polære molekyler har en permanent dipol, hvilket betyder, at de har en positiv ende og en negativ ende. Den positive ende af et molekyle kan tiltrække den negative ende af et andet molekyle, og omvendt. Denne tiltrækning skaber en dipol-dipol-kraft.
- Hydrogenbinding: Hydrogenbinding er en speciel type dipol-dipolkraft, der opstår mellem molekyler, der har et brintatom bundet til et nitrogen-, oxygen- eller fluoratom. Disse brintatomer har en delvis positiv ladning, og nitrogen-, oxygen- og fluoratomerne har en delvis negativ ladning. Dette skaber en stærk dipol-dipolkraft mellem hydrogenatomerne og nitrogen-, oxygen- eller fluoratomerne.
Van der Waals-kræfter er vigtige i en række biologiske processer, såsom stabling af DNA-molekyler i kernen og foldning af proteiner. De er også vigtige for materialers egenskaber, såsom faste stoffers hårdhed og styrke og væskers viskositet.
 Varme artikler
Varme artikler
-
 Lysforurening stjæler nattenLondon om natten fra den internationale rumstation. Jordens overflade bliver mere og mere oplyst af et lysere kunstigt natlys. Universal History Archive/Getty Images Tilbage i 1807, London blev den f
Lysforurening stjæler nattenLondon om natten fra den internationale rumstation. Jordens overflade bliver mere og mere oplyst af et lysere kunstigt natlys. Universal History Archive/Getty Images Tilbage i 1807, London blev den f -
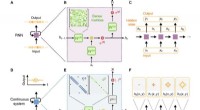 Bølgefysik som et analogt tilbagevendende neuralt netværkKonceptuel sammenligning af et standard RNN og et bølgebaseret fysisk system. (A) Diagram over en RNN-celle, der opererer på en diskret inputsekvens og producerer en diskret outputsekvens. (B) Interne
Bølgefysik som et analogt tilbagevendende neuralt netværkKonceptuel sammenligning af et standard RNN og et bølgebaseret fysisk system. (A) Diagram over en RNN-celle, der opererer på en diskret inputsekvens og producerer en diskret outputsekvens. (B) Interne -
 Effektiv og stabil emission af varmt hvidt lys fra blyfri halogenid-dobbeltperovskitterMekanistisk undersøgelse af PLQY i Cs2Ag1−xNaxInCl6. a) Overgangsdipolmoment (µ) i Cs2Ag1 − xNaxInCl6 som en funktion af Na -indhold i systemet. b) Paritetsændring af elektronbølgefunktionen i STE før
Effektiv og stabil emission af varmt hvidt lys fra blyfri halogenid-dobbeltperovskitterMekanistisk undersøgelse af PLQY i Cs2Ag1−xNaxInCl6. a) Overgangsdipolmoment (µ) i Cs2Ag1 − xNaxInCl6 som en funktion af Na -indhold i systemet. b) Paritetsændring af elektronbølgefunktionen i STE før -
 Lysbaseret metode forbedrer praktiske og kvalitet af fjernvindmålingerMingjia Shangguan og Haiyun Xia fra University of Science and Technology i Kina var en del af et forskerhold, der udviklede et nyt Doppler LIDAR-system til nøjagtig måling af vinden. Den har en meget
Lysbaseret metode forbedrer praktiske og kvalitet af fjernvindmålingerMingjia Shangguan og Haiyun Xia fra University of Science and Technology i Kina var en del af et forskerhold, der udviklede et nyt Doppler LIDAR-system til nøjagtig måling af vinden. Den har en meget
- Døde dyr, der lever i regnskoven
- Videnskabseksperiment: Hvordan man laver lactinsyre
- Afdække kraften i Amazonites betydning:Helbredende egenskaber og hverdagsbrug
- Video:Vi spurgte en NASA-forsker:Hvad hvis en asteroide skulle ramme Jorden?
- Hvad betyder forureningsbekæmpelse?
- Spark joy:Brug Marie Kondo-inspireret metode til at rydde op i din smartphone, tablet og laptop


