Hvordan adskiller resonansstrukturer sig?
Her er de vigtigste forskelle mellem resonansstrukturer:
1. Elektronfordeling:Resonansstrukturer viser forskellige arrangementer af π-elektroner og positionerne af dobbeltbindinger eller enlige par. Bevægelsen af elektroner mellem atomer for at opnå en mere stabil elektronisk konfiguration skaber disse variationer i elektronfordelingen.
2. Energiniveauer:Hver resonansstruktur har en specifik energi forbundet med sig. Den mest stabile resonansstruktur er den med den laveste energi. Denne struktur har normalt den mest omfattende delokalisering af elektroner, hvilket fører til en lavere samlet energitilstand.
3. Bindingslængder og bindingsordrer:Resonansstrukturer kan vise forskellige bindingslængder og bindingsrækkefølger. Bindingerne involveret i resonans er ofte angivet med fraktioneret bindingsrækkefølge, der repræsenterer den gennemsnitlige elektronfordeling over flere strukturer.
4. Bidrag til den overordnede struktur:Resonansstrukturer eksisterer ikke uafhængigt, men bidrager til den overordnede hybridstruktur af molekylet. Den faktiske struktur af molekylet er en superposition af alle resonansstrukturer, kendt som resonanshybriden.
5. Resonanshybrid:Resonanshybriden repræsenterer den sande elektroniske struktur af molekylet, der inkorporerer bidragene fra alle resonansstrukturer. Denne hybridstruktur har egenskaber, der er et gennemsnit af de individuelle strukturer, hvilket resulterer i øget stabilitet.
Det er vigtigt at bemærke, at resonansstrukturer er teoretiske konstruktioner, der bruges til at beskrive delokalisering af elektroner og give en bedre forståelse af den elektroniske struktur og binding i molekyler. Selvom disse strukturer ikke er egentlige molekylære arter, hjælper de med at forklare stabiliteten, egenskaberne og adfærden af molekyler med flere bindinger og ensomme par.
Sidste artikelRelative atommasser måles i?
Næste artikelHvor mange gange lettere er en elektron end en proton?
 Varme artikler
Varme artikler
-
 Forskere introducerer en ny måde at efterligne maskine af maskinerSom en lille lego, der klikker på plads, naturen sammensætter selvstændigt mikroskopiske byggesten. Levende systemer er biokemiske maskiner, der udmærker sig ved at bygge og flytte deres dele. Ligesom
Forskere introducerer en ny måde at efterligne maskine af maskinerSom en lille lego, der klikker på plads, naturen sammensætter selvstændigt mikroskopiske byggesten. Levende systemer er biokemiske maskiner, der udmærker sig ved at bygge og flytte deres dele. Ligesom -
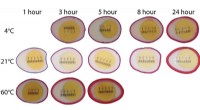 Brug af marinerede æg til at demonstrere diffusionSammenligning af farvestofindtrængning i æggehviderne ved forskellige temperaturer. Kredit:Carson Emeigh, Hyeonggeun Luke Bak, Dilziba Kizghin og Haipeng Zhang Marinerede eller syltede æg nydes af
Brug af marinerede æg til at demonstrere diffusionSammenligning af farvestofindtrængning i æggehviderne ved forskellige temperaturer. Kredit:Carson Emeigh, Hyeonggeun Luke Bak, Dilziba Kizghin og Haipeng Zhang Marinerede eller syltede æg nydes af -
 Restaurant akustik, der schmecktKlaus Genuit fotograferet i et anekoisk kammer med flere højttalere for at simulere et virtuelt akustisk landskab, samt et kunstigt hoved til binaural optagelse Credit:Genuit Akustik -konsulent Kl
Restaurant akustik, der schmecktKlaus Genuit fotograferet i et anekoisk kammer med flere højttalere for at simulere et virtuelt akustisk landskab, samt et kunstigt hoved til binaural optagelse Credit:Genuit Akustik -konsulent Kl -
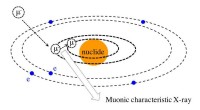 Muon -stråleanalyse af organisk stof i prøver fra rummetBegrebet Muonic karakteristisk røntgen. Kredit:Osaka University Muon har meget højere transmissivitet end elektroner og røntgenstråler. Denne funktion i muon har gjort det muligt for os at gennems
Muon -stråleanalyse af organisk stof i prøver fra rummetBegrebet Muonic karakteristisk røntgen. Kredit:Osaka University Muon har meget højere transmissivitet end elektroner og røntgenstråler. Denne funktion i muon har gjort det muligt for os at gennems
- NASA satellitdata viser Humbertos strukturændring
- Digitaliserede optegnelser fra dyrelivscentre viser de mest almindelige måder, hvorpå mennesker sk…
- Et instrument, der bruges til at adskille og komprimere et bundfald i reagensglas kaldes?
- Myanmar -virksomhed forsøger at gøre affald trendy
- Billeddannelse af ferroelektriske domæner
- Hvordan insekter adskiller forskellige sukkerarter


