Hvad er de kræfter, der holder partikler sammen af?
1. van der Waals styrker (også kaldet London-spredningskræfter):Disse kræfter er de svageste af de intermolekylære kræfter og opstår fra de midlertidige fluktuationer af elektrontæthed i atomer og molekyler. Når disse fluktuationer opstår, vil kernen i et atom være svagt positiv, og kernen i et andet atom vil være svagt negativ, hvilket skaber en dipol-dipol-interaktion. Denne dipol-dipol-interaktion er van der Waals-kraften. Van der Waals kræfter er vigtige for at holde ikke-polære molekyler sammen, såsom helium, neon og metan.
2. Brintbindinger: Hydrogenbindinger er stærkere end van der Waals-kræfter og opstår fra tiltrækningen mellem et brintatom, der er kovalent bundet til et elektronegativt atom (såsom nitrogen, oxygen eller fluor) og et andet elektronegativt atom. Hydrogenbindinger er ansvarlige for de høje kogepunkter for vand, alkoholer og andre hydrogenholdige forbindelser. De spiller også en afgørende rolle i strukturen af proteiner og nukleinsyrer.
3. Ionbindinger: Ionbindinger er de stærkeste af de intermolekylære kræfter og opstår fra tiltrækningen mellem en positivt ladet ion (kation) og en negativt ladet ion (anion). Ionbindinger findes i ioniske forbindelser, såsom natriumchlorid (NaCl) og kaliumiodid (KI).
Sidste artikelMængden af stof indeholdt i en genstand?
Næste artikelHvad er 43,9 c temperatur i f?
 Varme artikler
Varme artikler
-
 At sætte fotoner i fængselKredit:CC0 Public Domain Et miniaturefængsel for fotoner - det er nanorummet opdaget af forskere fra University of Twente. Det er et ekstremt lille hulrum omgivet af en optisk krystal, en struktur
At sætte fotoner i fængselKredit:CC0 Public Domain Et miniaturefængsel for fotoner - det er nanorummet opdaget af forskere fra University of Twente. Det er et ekstremt lille hulrum omgivet af en optisk krystal, en struktur -
 Forskere laver en plan for et kvantebatteri, der ikke mister opladningenKredit:CC0 Public Domain Forskere fra universiteterne i Alberta og Toronto udviklede en plan for et nyt kvantebatteri, der ikke lækker ladning. Et kvantebatteri er et lille, batteri i nanostørrel
Forskere laver en plan for et kvantebatteri, der ikke mister opladningenKredit:CC0 Public Domain Forskere fra universiteterne i Alberta og Toronto udviklede en plan for et nyt kvantebatteri, der ikke lækker ladning. Et kvantebatteri er et lille, batteri i nanostørrel -
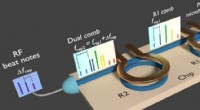 Dobbeltfrekvenskam genereret på en enkelt chip ved hjælp af en enkelt laserEn kompakt, integreret, siliciumbaseret chip, der bruges til at generere dobbelte kamme til ekstremt hurtig molekylær spektroskopi. Kredit:A. Dutt, A. Mohanty, E. Shim, G. Patwardhan/Columbia Engineer
Dobbeltfrekvenskam genereret på en enkelt chip ved hjælp af en enkelt laserEn kompakt, integreret, siliciumbaseret chip, der bruges til at generere dobbelte kamme til ekstremt hurtig molekylær spektroskopi. Kredit:A. Dutt, A. Mohanty, E. Shim, G. Patwardhan/Columbia Engineer -
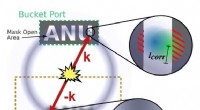 Quantum ghost-billeddannelse blev forbedret ved at bruge fem-atom-korrelationerSkematisk visning af højere ordens kvantespøgelsesbillede. Kredit:Hodgman et al. © 2019 American Physical Society I konventionelle billeddannelsesmetoder, en stråle af fotoner (eller andre partikl
Quantum ghost-billeddannelse blev forbedret ved at bruge fem-atom-korrelationerSkematisk visning af højere ordens kvantespøgelsesbillede. Kredit:Hodgman et al. © 2019 American Physical Society I konventionelle billeddannelsesmetoder, en stråle af fotoner (eller andre partikl


