Hvorfor er grundstoffers atommasser normalt ikke hele tal?
For eksempel har grundstoffet kulstof tre naturligt forekommende isotoper:kulstof-12, kulstof-13 og kulstof-14. Kulstof-12 har seks protoner og seks neutroner, kulstof-13 har seks protoner og syv neutroner, og kulstof-14 har seks protoner og otte neutroner. Atommassen af kulstof er ikke et helt tal, fordi det er et vægtet gennemsnit af masserne af dets isotoper, under hensyntagen til deres relative mængder. I tilfælde af kulstof er atommassen cirka 12,01 amu.
Derfor resulterer det vægtede gennemsnit af de isotopiske masser, der tager højde for deres relative mængder, i ikke-heltallige atommasser for de fleste grundstoffer.
Sidste artikelHar helium en komplet ydre skal?
Næste artikelHvad er formlen for hastighed og højde gennem et damprør?
 Varme artikler
Varme artikler
-
 Kraft og træk rolle tydeliggjort for svømmende mikroorganismerEt øjebliksbillede af en lineær kæde af tre små kugler og en stor kugle. De enkelte kugler udfører relativ oscillerende bevægelse langs aksen. Væsken konverterer den indre relative bevægelse til bevæg
Kraft og træk rolle tydeliggjort for svømmende mikroorganismerEt øjebliksbillede af en lineær kæde af tre små kugler og en stor kugle. De enkelte kugler udfører relativ oscillerende bevægelse langs aksen. Væsken konverterer den indre relative bevægelse til bevæg -
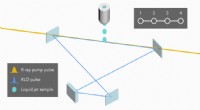 Looping røntgenstråler for at producere laserimpulser af højere kvalitetSkematisk arrangement af eksperimentet. Forskerne sender en røntgenpuls fra LCLS gennem en væskestråle, hvor det skaber exciterede atomer, der udsender en puls af stråling i en bestemt farve, der bevæ
Looping røntgenstråler for at producere laserimpulser af højere kvalitetSkematisk arrangement af eksperimentet. Forskerne sender en røntgenpuls fra LCLS gennem en væskestråle, hvor det skaber exciterede atomer, der udsender en puls af stråling i en bestemt farve, der bevæ -
 Neutronproduktion på ORNLs SNS når designeffektniveauSpallation Neutron Source ved Oak Ridge National Laboratory har nået sit designkraftdesignniveau ved at køre en neutronproduktionscyklus på 1,4 megawatt. Kredit:Oak Ridge National Laboratory Spall
Neutronproduktion på ORNLs SNS når designeffektniveauSpallation Neutron Source ved Oak Ridge National Laboratory har nået sit designkraftdesignniveau ved at køre en neutronproduktionscyklus på 1,4 megawatt. Kredit:Oak Ridge National Laboratory Spall -
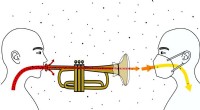 At spille blæseinstrumenter spreder flere vira end at trække vejret, men mindre end at tale eller …At spille blæseinstrumenter producerer mindre viral belastning end at tale eller synge, fordi instrumenterne fungerer som et filter for større partikler. Derudover kan et filter til instrumentet og at
At spille blæseinstrumenter spreder flere vira end at trække vejret, men mindre end at tale eller …At spille blæseinstrumenter producerer mindre viral belastning end at tale eller synge, fordi instrumenterne fungerer som et filter for større partikler. Derudover kan et filter til instrumentet og at
- Er det falsk, at lugten af et stof er et eksempel på en fysisk egenskab?
- Hvordan AI kan hjælpe med at kortlægge tegnsprog
- Hvordan overvandt genetiske parasitter det naturlige udvalg i milliarder af år?
- Team udvikler multisurface adhæsionssystem modelleret på græshoppefødder
- Genovervejelse af den private sektors rolle i katastrofehjælp
- Hurtigt 3D-mikroskop med nanopræcision


