En rumsonde har returneret prøver til jorden af krystaller fundet på en fjern planet. Ved at studere disse opdagede forsker, at 0,994 g prøve vil absorbere 202,7 J varme, når temperaturen?
$$c =\frac{Q}{m\Delta T}$$
hvor:
* c er den specifikke varmekapacitet i J/g°C
* Q er den varme, der absorberes i J
* m er prøvens masse i g
* ΔT er temperaturændringen i °C
I dette tilfælde har vi:
$$c =\frac{202.7 J}{0.994g \cdot \Delta T}$$
Vi kender ikke temperaturændringen, så vi kan ikke beregne den specifikke varmekapacitet. Vi kan dog sige, at den specifikke varmekapacitet er den mængde varme, der kræves for at hæve temperaturen på 1 gram af krystallen med 1 grad Celsius.
Sidste artikelHvilke kræfter bruges til at starte en raket?
Næste artikelHvorfor bærer en raket sin egen ilt?
 Varme artikler
Varme artikler
-
 Fodgængere holder en 75 cm komfortzone for at forhindre kollisionerKredit:CC0 Public Domain Fodgængere undgår konstant kollisioner med modkørende. Meter på forhånd ændrer de ubevidst deres gangbro for at passere hinanden. Fysikere ved Eindhoven University of Tech
Fodgængere holder en 75 cm komfortzone for at forhindre kollisionerKredit:CC0 Public Domain Fodgængere undgår konstant kollisioner med modkørende. Meter på forhånd ændrer de ubevidst deres gangbro for at passere hinanden. Fysikere ved Eindhoven University of Tech -
 Microbot origami kan fange, transportere enkeltcellerMagnetisk mikrobotoptagelse, trække og frigive en levende celle. Kredit:Koohee Han og Dr. Wyatt Shields, leveret af prof. Orlin D. Velev, NC State University. Forskere ved North Carolina State Uni
Microbot origami kan fange, transportere enkeltcellerMagnetisk mikrobotoptagelse, trække og frigive en levende celle. Kredit:Koohee Han og Dr. Wyatt Shields, leveret af prof. Orlin D. Velev, NC State University. Forskere ved North Carolina State Uni -
 Renoveringer fører til store forbedringer på Nuclear Astrophysics labI dette billede, mere end 2 kilowatt protonstråle, der rammer den vandkølede, wolframforstærket strålestop for enden af ECRIS-accelerationssøjlen, set gennem dens visningsportal. Kredit:Arthur E. Ch
Renoveringer fører til store forbedringer på Nuclear Astrophysics labI dette billede, mere end 2 kilowatt protonstråle, der rammer den vandkølede, wolframforstærket strålestop for enden af ECRIS-accelerationssøjlen, set gennem dens visningsportal. Kredit:Arthur E. Ch -
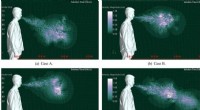 Forskere identificerer funktioner, der kan gøre nogen til en virus-supersprederNysehastigheden for fire forskellige næse- og mundtyper er vist. A er åben næsegang med tænder, B er åben næsegang uden tænder, C er blokeret næsepassage uden tænder, og D er blokeret næsepassage med
Forskere identificerer funktioner, der kan gøre nogen til en virus-supersprederNysehastigheden for fire forskellige næse- og mundtyper er vist. A er åben næsegang med tænder, B er åben næsegang uden tænder, C er blokeret næsepassage uden tænder, og D er blokeret næsepassage med
- Human Heart Science Projekter
- Var Cascadias jordskælv fra 1700 en del af en sekvens af jordskælv?
- Ledere kan lære af at overvåge fjernmedarbejdere under coronavirus
- Fald i atmosfærisk kuldioxid nøglen til gammel klimaovergang
- Undersøgelse undersøger, hvordan modsatrettede synspunkter kan have påvirket tøven med vacciner
- Netværket udvides til 256 gange dets oprindelige størrelse for at bygge bro mellem mikro- og makro…


