Hvordan måling af en elektronposition ændrer sin hastighed?
Heisenberg usikkerhedsprincip
Det centrale princip, der er ved spil, er usikkerhedsprincippet om Heisenberg . Det siger, at du ikke samtidig kan kende både position og momentum (og derfor hastighed) af en partikel med perfekt nøjagtighed. Jo mere præcist du bestemmer en, desto mindre præcist kan du bestemme den anden.
Hvorfor måling af position påvirker hastighed
1. bølgepartikel dualitet: Elektroner udviser som alle kvantepartikler bølgepartikel-dualitet. De opfører sig både som partikler med en defineret position og som bølger med et defineret momentum (relateret til hastighed).
2. måling som interaktion: Når du forsøger at måle en elektrons position, interagerer du uundgåeligt med den. Denne interaktion forstyrrer sin bølgeagtige natur.
3. Bølgeamling: Målingshandlingen tvinger elektronens bølgefunktion til at "kollapse", hvilket betyder, at den overgår fra en superposition af flere mulige positioner til en enkelt, bestemt position.
4. momentumusikkerhed: Dette sammenbrud af bølgefunktionen introducerer usikkerhed i elektronens momentum. Denne usikkerhed er omvendt proportional med nøjagtigheden af din positionsmåling. Jo mere præcis din positionsmåling er, jo større er usikkerheden i momentum (og dermed hastighed).
analogi
Forestil dig at prøve at finde en bestemt bølge på havet. Du kan bruge en bøje til at markere dens position. Handlingen med at placere bøjen forstyrrer imidlertid bølgen og ændrer dens retning og momentum.
Konklusion
Måling af en elektrons position påvirker iboende dens hastighed på grund af bølgepartikel-dualiteten og den uundgåelige måling af måling. Dette er et grundlæggende princip for kvantemekanik, og det har dybe konsekvenser for vores forståelse af den subatomiske verden.
 Varme artikler
Varme artikler
-
 Forklarer den stigende temperatur ved køling af granulatgasserAggregering af granulære gasser i rummet. Kredit:University of Leicester En matematiker fra Leicester har udviklet en teori til at forklare opvarmning ved køling, hvor temperaturen på en granulatg
Forklarer den stigende temperatur ved køling af granulatgasserAggregering af granulære gasser i rummet. Kredit:University of Leicester En matematiker fra Leicester har udviklet en teori til at forklare opvarmning ved køling, hvor temperaturen på en granulatg -
 Farven på magneterUrii Guchenia, venstre, og Ran Hong holder stolt en farvet glas-gengivelse op af magnetfeltet i Muon g-2-eksperimentets lagerring. Kredit:Ran Hong Partikelfysik og dekorative glasvarer er to disci
Farven på magneterUrii Guchenia, venstre, og Ran Hong holder stolt en farvet glas-gengivelse op af magnetfeltet i Muon g-2-eksperimentets lagerring. Kredit:Ran Hong Partikelfysik og dekorative glasvarer er to disci -
 Forskere realiserer effektiv generering af højdimensionel kvanteteleportationKredit:CC0 Public Domain I en undersøgelse offentliggjort i Fysisk gennemgangsbreve , et hold ledet af akademiker Guo Guangcan fra University of Science and Technology of China (USTC) fra det ki
Forskere realiserer effektiv generering af højdimensionel kvanteteleportationKredit:CC0 Public Domain I en undersøgelse offentliggjort i Fysisk gennemgangsbreve , et hold ledet af akademiker Guo Guangcan fra University of Science and Technology of China (USTC) fra det ki -
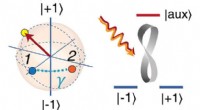 Simpelt er smukt i kvanteberegningKvantecomputere bruger elektronspin-orientering på et defekt sted i diamant til at lagre information. Elektronspin kan være op (+1), nede (-1), eller noget midt imellem. Spindet (venstre, rød pil) er
Simpelt er smukt i kvanteberegningKvantecomputere bruger elektronspin-orientering på et defekt sted i diamant til at lagre information. Elektronspin kan være op (+1), nede (-1), eller noget midt imellem. Spindet (venstre, rød pil) er
- Hvordan overtro spredes
- The Psychology of Black Friday
- Atmosfærens emissionsfingeraftryk påvirkes af, hvordan skyer stables
- Undersøgelse identificerer forskellige grupper, der er interesseret i typer elbiler
- Sådan beregnes kortslutningsbedømmelsen
- Hvordan to metaldetektorer opdagede en komplet romersk skat


