Hvorfor hopper elektron fra jordtilstand til afdelt tilstand?
1. Kvantemekanik: Elektroner i atomer findes i kvantiserede energiniveau, hvilket betyder, at de kun kan optage specifikke, diskrete energiforhold. Jordtilstanden er det laveste energiniveau, og højere energiniveau kaldes ophidsede tilstande.
2. Energiabsorption: For at et elektron skal hoppe til et højere energiniveau (ophidset tilstand), skal det absorbere En specifik mængde energi, der nøjagtigt matcher energiforskellen mellem jordtilstanden og den ophidsede tilstand.
3. Hvordan energi absorberes:
* Fotoner: Den mest almindelige måde er ved at absorbere en foton (en pakke lysenergi). Fotonens energi skal være lig med energiforskellen mellem de to niveauer. Dette er grunden til, at forskellige elementer absorberer specifikke bølgelængder af lys, hvilket fører til unikke spektrale linjer.
* Kollisioner: Elektroner kan også få energi gennem kollisioner med andre partikler (som elektroner eller atomer), hvis kollisionen har nok energi.
4. Excitation er midlertidig: En elektron i en ophidset tilstand er ustabil. Det vil til sidst frigive den absorberede energi og vende tilbage til jordtilstanden. Denne energiudgivelse kan ske på nogle få måder:
* udsender en foton: Elektronet udsender en foton med den samme energi, som den absorberede, hvilket resulterer i emission af lys.
* Ikke-strålende forfald: Elektronet mister energi gennem kollisioner og overfører den til andre partikler.
Kortfattet:
Elektroner "hopper" ikke bare til ophidsede stater på et indfald. De kræver en specifik energiindgang, normalt fra at absorbere en foton eller kollidere med en anden partikel. Denne energiindgang skal matche forskellen mellem jordtilstand og den ønskede ophidsede tilstand. Når den er ophidset, vil elektronet til sidst vende tilbage til jordtilstanden og frigive den absorberede energi.
Sidste artikelHvad sker der med et materiale under duktil deformation?
Næste artikelHvad er en baals vindtunnel?
 Varme artikler
Varme artikler
-
 Miniaturiserede varmemotorer kunne drive fremtidens nanoskala -maskinerKredit:University of Manchester Forskning fra University of Manchester har kastet nyt lys over brugen af miniaturiserede varmemotorer, der en dag kunne hjælpe med at drive nanoskala -maskiner so
Miniaturiserede varmemotorer kunne drive fremtidens nanoskala -maskinerKredit:University of Manchester Forskning fra University of Manchester har kastet nyt lys over brugen af miniaturiserede varmemotorer, der en dag kunne hjælpe med at drive nanoskala -maskiner so -
 Lynets elektromagnetiske felter kan have beskyttende egenskaberKredit:CC0 Public Domain Lyn var den vigtigste elektromagnetiske tilstedeværelse i Jordens atmosfære længe før opfindelsen af elektricitet. Der er nogle 2, 000 tordenvejr aktive til enhver tid,
Lynets elektromagnetiske felter kan have beskyttende egenskaberKredit:CC0 Public Domain Lyn var den vigtigste elektromagnetiske tilstedeværelse i Jordens atmosfære længe før opfindelsen af elektricitet. Der er nogle 2, 000 tordenvejr aktive til enhver tid, -
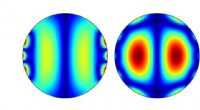 Ny metode til brug af spinbølger i magnetiske materialerMagnetiske simuleringer til magnetiske diske, der måler 0,5 mikrometer i diameter. De rumlige fordelinger af dynamisk magnetisering i permalloy (venstre) og kobolt og nikkel (højre) kan ses. Kredit:B.
Ny metode til brug af spinbølger i magnetiske materialerMagnetiske simuleringer til magnetiske diske, der måler 0,5 mikrometer i diameter. De rumlige fordelinger af dynamisk magnetisering i permalloy (venstre) og kobolt og nikkel (højre) kan ses. Kredit:B. -
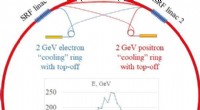 Energi-genopretning lineær accelerator foreslået til næste generations fysikforskningMuligt layout af en energigendannelseslinac (ERL) elektron-positron-kollider. Stråler af elektroner og positroner ville hver især blive accelereret i etaper i løbet af fire passager gennem to superled
Energi-genopretning lineær accelerator foreslået til næste generations fysikforskningMuligt layout af en energigendannelseslinac (ERL) elektron-positron-kollider. Stråler af elektroner og positroner ville hver især blive accelereret i etaper i løbet af fire passager gennem to superled
- Hvad er lig med 10 cm i km?
- Hvordan ulovligt fiskeri skader Nigeria, og hvad skal man gøre ved det
- Kan solenergi redde bierne?
- Hvordan små kromosomer konkurrerer med store om en celles opmærksomhed
- Det tungeste dyr nogensinde? Forskere opdager massive gamle hvaler
- Hvordan ændrede kvantemekanik forståelsen af atomer?


