Er det sandt i en stiv beholder, når gasmolekylernes hastighed øges også?
* kinetisk molekylær teori: Gassens opførsel forklares af den kinetiske molekylære teori. Et af de vigtigste principper er, at den gennemsnitlige kinetiske energi af gasmolekyler er direkte proportional med den absolutte temperatur.
* Temperatur og hastighed: Kinetisk energi er relateret til molekylernes hastighed. Derfor Hvis du øger temperaturen på en gas, øges molekylernes gennemsnitlige hastighed.
* stiv beholder: I en stiv beholder er volumenet konstant. Dette betyder, at gasmolekylerne har en fast plads til at bevæge sig rundt i.
* øgede kollisioner: Når molekylerne bevæger sig hurtigere, kolliderer de hyppigere med containerens vægge og med større kraft. Dette er grunden til, at trykket inde i beholderen øges, når du opvarmer gassen.
Kortfattet: I en stiv beholder, når hastigheden af gasmolekyler øges (på grund af en stigning i temperatur), øges trykket inde i beholderen også på grund af den øgede frekvens og kraften af kollisioner med væggene.
Sidste artikelHvorfor lys er hurtigere end lyd?
Næste artikelEr det sandt, at deres ikke trækkes kræfter mellem partiklerne i en gas?
 Varme artikler
Varme artikler
-
 Flytning af mikroskopi ud over opløsningsgrænsenBillede af mikrotubuli i en fast celleprøve. En 3 μm x 3 μm konfokal scanning af mikrotubuli i en fast 3T3 celle mærket med kvanteprikker analyseret på to måder. Øverst til venstre:billedscanningsmikr
Flytning af mikroskopi ud over opløsningsgrænsenBillede af mikrotubuli i en fast celleprøve. En 3 μm x 3 μm konfokal scanning af mikrotubuli i en fast 3T3 celle mærket med kvanteprikker analyseret på to måder. Øverst til venstre:billedscanningsmikr -
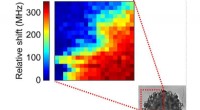 Mekaniske egenskaber for tumorer målt ved Brillouin lysspredningKortlægning af tumormodellernes stivhed. Mørkerød angiver de mest stive områder, mod tumorens indre. Kanten er mindre stiv (gulgrøn). Kredit:Thomas Dehoux/ILM/CNRS Et team af fysikere ved Institut
Mekaniske egenskaber for tumorer målt ved Brillouin lysspredningKortlægning af tumormodellernes stivhed. Mørkerød angiver de mest stive områder, mod tumorens indre. Kanten er mindre stiv (gulgrøn). Kredit:Thomas Dehoux/ILM/CNRS Et team af fysikere ved Institut -
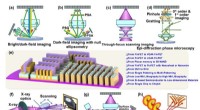 Inspektion af optisk wafer-defekt ved 10 nm teknologiknudepunktet og videreForskellige inspektionssystemer for optiske waferdefekter, herunder (a) Brightfield/darkfield-billeddannelsessystem, (b) Dark-field-billeddannelse med nulellipsometri, (c) Scanningsmikroskopi med genn
Inspektion af optisk wafer-defekt ved 10 nm teknologiknudepunktet og videreForskellige inspektionssystemer for optiske waferdefekter, herunder (a) Brightfield/darkfield-billeddannelsessystem, (b) Dark-field-billeddannelse med nulellipsometri, (c) Scanningsmikroskopi med genn -
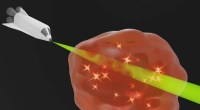 Gennemsigtighed efter behov:En ny proces kan gøre kunstige materialer gennemsigtige eller endda hel…Induceret gennemsigtighed:Den præcise styring af energistrømmen (indikeret ved glødende partikler i tågen) gør, at det kunstige materiale bliver helt gennemsigtigt for det optiske signal. Kredit:Andre
Gennemsigtighed efter behov:En ny proces kan gøre kunstige materialer gennemsigtige eller endda hel…Induceret gennemsigtighed:Den præcise styring af energistrømmen (indikeret ved glødende partikler i tågen) gør, at det kunstige materiale bliver helt gennemsigtigt for det optiske signal. Kredit:Andre
- Jordrige jernkatalyse giver adgang til værdifulde dialkylerede forbindelser
- Om forskellige typer Sand
- Ny australsk pterosaur kan have overlevet længst
- Vanity plader i Grækenland kan være en form for iøjnefaldende korruption
- Hvad sker der med temperatur og tryk, når dybden under jordens overflade øges?
- Far Cry 5 rekordsalg bøje gamemaker Ubisofts aktier


