Atomradius _ Moving fra venstre mod højre over en periode?
* Øget nuklearafgift: Når du bevæger dig over en periode, øges antallet af protoner i kernen. Dette fører til en stærkere positiv ladning, der tiltrækker elektronerne.
* samme elektronskal: Elektroner føjes til det samme energiniveau (samme elektronskal), når du bevæger dig over en periode.
* afskærmningseffekt: Mens antallet af elektroner stiger, forbliver antallet af indre elektronskaller det samme. Dette betyder, at afskærmningseffekten fra de indre elektroner på de yderste elektroner forbliver relativt konstant.
Kombineret effekt: Den øgede nukleare ladning trækker elektronerne tættere på kernen og opvejer effekten af den øgede elektronelektroniske frastødning. Dette resulterer i en mindre atomradius.
Eksempel:
* Lithium (Li) har en større atomradius end fluor (F), fordi Li har en mindre atomladning, og dets yderste elektron er længere væk fra kernen.
 Varme artikler
Varme artikler
-
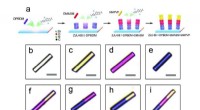 Den MOF-baserede flerfarvede single-mode mikrolaseren, den skematiske syntese af hierarkisk farvestofsamlede hybrid ZJU-68 mikrokrystaller. b-i, de optiske mikrografer af ZJU-68 (b) og hierarkisk farvestofsamlede ZJU-68 mikrokrystaller (c-i), skala ba
Den MOF-baserede flerfarvede single-mode mikrolaseren, den skematiske syntese af hierarkisk farvestofsamlede hybrid ZJU-68 mikrokrystaller. b-i, de optiske mikrografer af ZJU-68 (b) og hierarkisk farvestofsamlede ZJU-68 mikrokrystaller (c-i), skala ba -
 Drøm om ubegrænset, ren nuklear fusionsenergi inden for rækkeviddeNuklear fusionsenergi kunne være en afgørende bæredygtig energikilde som supplement til vedvarende energi. Verdens største fusionseksperiment, ITER, bygges i Frankrig. Kredit:© ITER Organization, www.
Drøm om ubegrænset, ren nuklear fusionsenergi inden for rækkeviddeNuklear fusionsenergi kunne være en afgørende bæredygtig energikilde som supplement til vedvarende energi. Verdens største fusionseksperiment, ITER, bygges i Frankrig. Kredit:© ITER Organization, www. -
 Gennembrud forbedrer i høj grad den ultrahurtige opløsning, der kan opnås med røntgenfrielektron…Kunstnerisk skildring af XFEL-måling med neongas. Den iboende forsinkelse mellem emissionen af fotoelektroner og Auger-elektroner fører til en karakteristisk ellipse i de analyserede data. I princip
Gennembrud forbedrer i høj grad den ultrahurtige opløsning, der kan opnås med røntgenfrielektron…Kunstnerisk skildring af XFEL-måling med neongas. Den iboende forsinkelse mellem emissionen af fotoelektroner og Auger-elektroner fører til en karakteristisk ellipse i de analyserede data. I princip -
 Bredbåndsakromatiske metaller fokuserer lys uanset polariseringDisse nydesignede nanostrukturer på overfladen af et metal kan fokusere lys uanset dets polarisering, fordobling af linsens effektivitet. Kredit:Capasso Lab/Harvard SEAS Vi lever i en polarisere
Bredbåndsakromatiske metaller fokuserer lys uanset polariseringDisse nydesignede nanostrukturer på overfladen af et metal kan fokusere lys uanset dets polarisering, fordobling af linsens effektivitet. Kredit:Capasso Lab/Harvard SEAS Vi lever i en polarisere
- Hvordan planetariske tåger får deres former
- Hvad er noget i klasseværelset, der har termisk energi?
- Har den flydende stofstilstand et større volumen end dens solide tilstand?
- Sådan beregnes forstørrelse på et lysmikroskop
- Billede:Wavemaker moon Daphnis
- Ny model forudsiger præcist, hvordan kyster vil blive påvirket af storme og havniveaustigning


