Hvordan ville du beregne atommassen af atom uden at bruge periodisk tabel, hvis du kender nummerprotoner elektroner og neutroner?
Forståelse af atommasse
* Protoner og neutroner: Disse partikler udgør kernen i et atom og bidrager væsentligt til dets masse.
* Elektroner: Elektroner har en ubetydelig masse sammenlignet med protoner og neutroner, så de er typisk ikke inkluderet i atommasseberegningen.
Beregning
1. Identificer antallet af protoner (atomnummer): Antallet af protoner definerer elementet.
2. Identificer antallet af neutroner: Dette findes ofte i problemet, eller du kan beregne det ved at trække atomnummeret fra massenummeret.
3. Tilføj antallet af protoner og neutroner: Denne sum giver dig atommassen af atomet.
Eksempel:
Lad os sige, at du har et atom med:
* 6 protoner
* 6 neutroner
* 6 elektroner
1. atomnummer: 6 (antal protoner)
2. atommasse: 6 (protoner) + 6 (neutroner) =12
Vigtige noter:
* atommasseenhed (AMU): Atommassen udtrykkes i atommasseenheder (AMU). En AMU er omtrent lig med massen af en proton eller neutron.
* isotoper: Atomer af det samme element kan have forskellige antal neutroner, hvilket fører til isotoper. Den atommasse, du beregner, repræsenterer massen af en specifik isotop.
* gennemsnitlig atommasse: Den periodiske tabel viser den gennemsnitlige atommasse for hvert element under hensyntagen til den naturlige overflod af forskellige isotoper.
Fortæl mig, hvis du gerne vil øve med et andet eksempel!
Sidste artikelEr massetal det samme som atomnummer?
Næste artikelHvad er atommasseenheden for protoner og neutroner?
 Varme artikler
Varme artikler
-
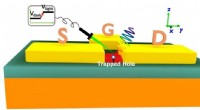 Quantum dots muliggør hurtigere, lettere fotondetektering, mere sikre dataSkematisk diagram over den enkelte foton detektor. Fotonen repræsenteres af den bølgede flerfarvede linje, og den røde prik repræsenterer kvantepunktet. Kredit:Yang Zhang Et team af forskere, heru
Quantum dots muliggør hurtigere, lettere fotondetektering, mere sikre dataSkematisk diagram over den enkelte foton detektor. Fotonen repræsenteres af den bølgede flerfarvede linje, og den røde prik repræsenterer kvantepunktet. Kredit:Yang Zhang Et team af forskere, heru -
 Fingerspidser reagerede forskelligt på forskellige overfladerSmå kryds mellem fingeraftryksramme og en glat overflade, der vokser og hænger sammen med stigende kontakttid. Kredit:Brygida Dzidek. (Phys.org) - Et team af forskere fra University of Birmingham,
Fingerspidser reagerede forskelligt på forskellige overfladerSmå kryds mellem fingeraftryksramme og en glat overflade, der vokser og hænger sammen med stigende kontakttid. Kredit:Brygida Dzidek. (Phys.org) - Et team af forskere fra University of Birmingham, -
 Fejlfri ind i kvantecomputerens tidsalderFejlfri ind i Quantum Computer Age. Kredit:H. Ritsch/IQOQI En undersøgelse ledet af fysikere ved Swansea University i Wales, udført af et internationalt hold af forskere og publiceret i tidsskrift
Fejlfri ind i kvantecomputerens tidsalderFejlfri ind i Quantum Computer Age. Kredit:H. Ritsch/IQOQI En undersøgelse ledet af fysikere ved Swansea University i Wales, udført af et internationalt hold af forskere og publiceret i tidsskrift -
 Mørk materie orkan giver mulighed for at opdage aksionerKredit:C. OHare; NASA/Jon Lomberg, via Fysik Et team af forskere fra Universidad de Zaragoza, Kings College London og Institute of Astronomy i U.K. har fundet ud af, at en mørk materie -orkan, d
Mørk materie orkan giver mulighed for at opdage aksionerKredit:C. OHare; NASA/Jon Lomberg, via Fysik Et team af forskere fra Universidad de Zaragoza, Kings College London og Institute of Astronomy i U.K. har fundet ud af, at en mørk materie -orkan, d
- Hvorfor går pendulet ikke så højt, når det svinger tilbage. Hvor går tabt potentiel energi hen?…
- Hvad er forskellen mellem Garmin Nuvi 350 og Street Pilot?
- Forskere finder, at aminosyren arginin kan have spillet en vigtigere rolle i livets kemiske oprindel…
- Hvad er Base 10 Blocks?
- Daimler får mega bøde i dieselsonde
- Studieøjebliksbillede:Utestede optagelser


