Har elementerne i periodisk tabel samme masse?
Her er hvorfor:
* atomnummer: Hvert element defineres af dets atomnummer, der repræsenterer antallet af protoner i dets kerne.
* Protoner og neutroner: Protoner og neutroner udgør næsten hele atomets masse.
* isotoper: De fleste elementer har isotoper, som er atomer af det samme element med forskellige antal neutroner. Dette betyder, at deres atommasser kan variere.
Eksempel:
* carbon Har et atomnummer på 6, hvilket betyder, at det altid har 6 protoner.
* carbon-12 har 6 neutroner, der fremstiller sin atommasse 12.
* carbon-14 har 8 neutroner, der fremstiller sin atommasse 14.
Konklusion:
Den periodiske tabel viser den gennemsnitlige atommasse for hvert element under hensyntagen til den naturlige overflod af dens isotoper. Mens elementer deler det samme antal protoner, kan deres masser variere på grund af tilstedeværelsen af isotoper.
Sidste artikelHvad er atommassen af elementbor?
Næste artikelEr massetal det samme som atomnummer?
 Varme artikler
Varme artikler
-
 Optisk spændt strukturel overgang hurtigste elektroniske switch, der nogensinde er observeretElektrondiffraktionsmønstre og overfladestrukturer. Kredit:(c) Natur (2017). DOI:10.1038/nature21432 (Phys.org) - Et team af forskere fra flere institutioner i Tyskland har brugt laserpulser til
Optisk spændt strukturel overgang hurtigste elektroniske switch, der nogensinde er observeretElektrondiffraktionsmønstre og overfladestrukturer. Kredit:(c) Natur (2017). DOI:10.1038/nature21432 (Phys.org) - Et team af forskere fra flere institutioner i Tyskland har brugt laserpulser til -
 Hvordan mælkebøttefrø fungerer som en perfekt pipette i laboratorietEn ingeniør ved Washington University i St. Louis har opdaget en ny anvendelse til et ondartet ukrudt. Kredit:Washington University i St. Louis Taraxacum officinale, bedre kendt som den almindelig
Hvordan mælkebøttefrø fungerer som en perfekt pipette i laboratorietEn ingeniør ved Washington University i St. Louis har opdaget en ny anvendelse til et ondartet ukrudt. Kredit:Washington University i St. Louis Taraxacum officinale, bedre kendt som den almindelig -
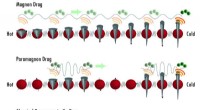 Paramagnetiske spins tager elektroner til en tur, producere elektricitet fra varmeMagnon-elektron træk er en advektiv effekt mellem magnoner (bølger af recession i spins af individuelle atomer &repræsenteret som små grå kegler) og elektroner (grønne prikker). Den termiske gradient
Paramagnetiske spins tager elektroner til en tur, producere elektricitet fra varmeMagnon-elektron træk er en advektiv effekt mellem magnoner (bølger af recession i spins af individuelle atomer &repræsenteret som små grå kegler) og elektroner (grønne prikker). Den termiske gradient -
 Kvantesimulering kan hjælpe flyvninger til at køre til tidenKvantesimulatorer kan hjælpe med at løse logistiske udfordringer, såsom at sørge for, at fly og flybesætning er på det rigtige sted, for at flyvninger kan køre gnidningsløst. Kredit:Pixabay/ Free-Phot
Kvantesimulering kan hjælpe flyvninger til at køre til tidenKvantesimulatorer kan hjælpe med at løse logistiske udfordringer, såsom at sørge for, at fly og flybesætning er på det rigtige sted, for at flyvninger kan køre gnidningsløst. Kredit:Pixabay/ Free-Phot
- Hvad gør massen af kg på Neptune?
- Hvad er formlen for Xrays?
- Hvad er en elektrisk edderkoppekasse?
- Chilenske miljøforkæmpere kæmper for at beskytte gletsjere mod minestøv
- Nye beviser for mørkt stof gør det endnu mere eksotisk
- Hvilket bundfald er mest sandsynligt at danne BA plus 2 Na 1 OH-1 og C03-2?


