Hvordan adskiller massenummeret sig fra gennemsnitlig atommasse?
massenummer
* Definition: Det samlede antal protoner og neutroner i en atoms kerne.
* hvad det fortæller os: Massen af et individuelt atom, med bidraget fra elektroner, der er ubetydelig.
* hvordan det bestemmes: Det beregnes ved at tilføje antallet af protoner (atomnummer) og neutroner.
* Eksempel: Carbon-12 har 6 protoner og 6 neutroner, så dets massetal er 12.
Gennemsnitlig atommasse
* Definition: Det vægtede gennemsnit af masserne af alle naturligt forekommende isotoper af et element.
* hvad det fortæller os: Den gennemsnitlige masse af et atom af et element som findes i naturen.
* hvordan det bestemmes: Beregnet ved at overveje forekomsten af hver isotop og dets massetal.
* Eksempel: Carbon har to hovedisotoper:carbon-12 (98,9% overflod) og carbon-13 (1,1% overflod). Den gennemsnitlige atommasse af kulstof er cirka 12.011 amu.
Nøgleforskelle:
* massenummer er et helt tal, mens gennemsnitlig atommasse normalt er en decimal. Dette skyldes, at gennemsnitlig atommasse tegner sig for de forskellige andele af isotoper.
* Massetal henviser til en bestemt isotop, mens den gennemsnitlige atommasse repræsenterer hele elementet.
* Massenummer ændres ikke for en specifik isotop, mens den gennemsnitlige atommasse kan ændres lidt på grund af variationer i isotopisk overflod.
Kortfattet:
* Massenummer fokuserer på den enkelte atoms sammensætning.
* Gennemsnitlig atommasse repræsenterer den gennemsnitlige masse af et element i dets naturlige tilstand i betragtning af bidragene fra alle dens isotoper.
Sidste artikelHvorfor påvirker en magnet videobånd?
Næste artikelHvordan ved du, at den tredje lov om termodynamik er sandt?
 Varme artikler
Varme artikler
-
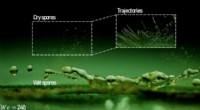 Minitornadoer af sporer belyst under regndråberBillede af luft-hvirvelspredning af plantepatogen. We -værdien repræsenterer slagets hastighed og overfladespænding af vand. Foto med tilladelse til Hyunggon Park. Kredit:Virginia Tech Plantsygdom
Minitornadoer af sporer belyst under regndråberBillede af luft-hvirvelspredning af plantepatogen. We -værdien repræsenterer slagets hastighed og overfladespænding af vand. Foto med tilladelse til Hyunggon Park. Kredit:Virginia Tech Plantsygdom -
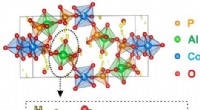 Elektrondiffraktion lokaliserer brintatomerRepræsentation af strukturen af et koboltaluminophosphat, overlejret på et kort, der viser maksima (i gult) forbundet med brintpositionerne, efter analyse af elektrondiffraktionsdataene. Kredit:P. B
Elektrondiffraktion lokaliserer brintatomerRepræsentation af strukturen af et koboltaluminophosphat, overlejret på et kort, der viser maksima (i gult) forbundet med brintpositionerne, efter analyse af elektrondiffraktionsdataene. Kredit:P. B -
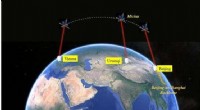 Team bygger verdens første rumjordede integrerede kvantekommunikationsnetværkDette billede viser besked, der sendes fra Wien til Beijing gennem rumjord integreret kvantenetværk. Kredit:PAN Jianweis gruppe Den første kvantesikre videokonference blev afholdt mellem præsident
Team bygger verdens første rumjordede integrerede kvantekommunikationsnetværkDette billede viser besked, der sendes fra Wien til Beijing gennem rumjord integreret kvantenetværk. Kredit:PAN Jianweis gruppe Den første kvantesikre videokonference blev afholdt mellem præsident -
 Forskere vil hjælpe rørledningsindustrien med at begrænse boblernes ødelæggende kraftKredit:CC0 Public Domain Forskere har besvaret nøglespørgsmål for at hjælpe med at forhindre skader og forbedre sikkerheden ved hydrauliske systemer, der bruges til rørledninger, vandturbiner og a
Forskere vil hjælpe rørledningsindustrien med at begrænse boblernes ødelæggende kraftKredit:CC0 Public Domain Forskere har besvaret nøglespørgsmål for at hjælpe med at forhindre skader og forbedre sikkerheden ved hydrauliske systemer, der bruges til rørledninger, vandturbiner og a
- Hvad er forskellen på en menneskelig kindcelle og bladcelle?
- Effektivitetsboost:Dobbelt lysimpulser minimerer energi til faseovergange
- Facebook accepterer at betale bøde i Cambridge Analytica-skandalen
- Graphene beviser et langtidsholdbart smøremiddel
- Hvis du fløj over et jordskælv, ville du så mærke flyet ryste?
- Hvad er længden af kløften ved Niagara Falls?


