Hvad sker der med tryk, når temperaturen og volumenet er halveret?
forståelse af forholdet
Forholdet mellem tryk, temperatur og volumen er beskrevet af kombineret gaslov , som er en kombination af Boyle's Law og Charles 'lov:
* Boyle's lov: Ved konstant temperatur er tryk og volumen omvendt proportional.
* Charles 'lov: Ved konstant tryk er volumen og temperatur direkte proportional.
Effekten af halveringstemperatur og volumen
* Halvning af temperaturen: Når du halverer temperaturen, reducerer du i det væsentlige den gennemsnitlige kinetiske energi for gasmolekylerne. Dette betyder, at de kolliderer med containervæggene sjældnere og med mindre kraft, hvilket fører til et fald i tryk .
* Halvning af lydstyrken: Når du halverer lydstyrken, tvinger du det samme antal gasmolekyler til et mindre rum. Dette øger hyppigheden og kraften af kollisioner med containervæggene, hvilket resulterer i en stigning i tryk .
Den kombinerede effekt
Da du halverer både temperatur og volumen, vil virkningerne på tryk imod hinanden.
* Faldet i tryk på grund af temperaturændringen modvirkes af stigningen i trykket på grund af volumenændringen.
Resultatet
Trykket forbliver uændret .
Matematisk repræsentation
Den kombinerede gaslov kan repræsenteres som:
(P₁v₁) / t₁ =(p₂v₂) / t₂
Hvor:
* P₁ og P₂ er indledende og endelige pres
* V₁ og V₂ er indledende og endelige bind
* T₁ og T₂ er indledende og sidste temperaturer
Hvis du halverer både temperatur og volumen (V₂ =V₁/2 og T₂ =T₁/2), bliver ligningen:
(P₁v₁) / t₁ =(p₂ (v₁ / 2)) / (t₁ / 2)
Forenklet, får du:
P₁ =P₂
Derfor forbliver trykket konstant.
 Varme artikler
Varme artikler
-
 Første måling af flow -reversering af negative ionerStrømtætheden nåede 340 A/m2 ved den maksimale indsprøjtningseffekt. Denne værdi kan sammenlignes med målet for ITER NBI. Kredit:Dr. Masashi Kisaki Det er lykkedes National Institutes of Natural S
Første måling af flow -reversering af negative ionerStrømtætheden nåede 340 A/m2 ved den maksimale indsprøjtningseffekt. Denne værdi kan sammenlignes med målet for ITER NBI. Kredit:Dr. Masashi Kisaki Det er lykkedes National Institutes of Natural S -
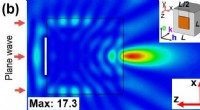 Forskere kontrollerer en måde, hvorpå man kan forbedre opløsningen af de mest kraftfulde mikros…Simuleret fordeling af nærfelt E 2-feltforbedring på xz-plan med amplitude-maske-apodisering. Kredit:Tomsk Polytechnic University Forskere fra Tomsk Polytechnic University (Rusland) og Bangor Univ
Forskere kontrollerer en måde, hvorpå man kan forbedre opløsningen af de mest kraftfulde mikros…Simuleret fordeling af nærfelt E 2-feltforbedring på xz-plan med amplitude-maske-apodisering. Kredit:Tomsk Polytechnic University Forskere fra Tomsk Polytechnic University (Rusland) og Bangor Univ -
 Tage signaler fra naturen, banebrydende cellulær fluidics-teknologi kan have omfattende konsekvense…Inspireret af den måde, planter optager og distribuerer vand og næringsstoffer på, Lawrence Livermore National Laboratory-forskere har udviklet en banebrydende metode til transport af væsker og gasser
Tage signaler fra naturen, banebrydende cellulær fluidics-teknologi kan have omfattende konsekvense…Inspireret af den måde, planter optager og distribuerer vand og næringsstoffer på, Lawrence Livermore National Laboratory-forskere har udviklet en banebrydende metode til transport af væsker og gasser -
 Korrelationer i væksten i COVID-19 peger på universelle strategier til at bremse spredningenDet samlede antal bekræftede inficerede tilfælde af COVID-19 som funktion af tiden i ni lande, eksklusive dage med færre end 100 smittede. De sorte kontinuerlige kurver repræsenterer en lovlovsregress
Korrelationer i væksten i COVID-19 peger på universelle strategier til at bremse spredningenDet samlede antal bekræftede inficerede tilfælde af COVID-19 som funktion af tiden i ni lande, eksklusive dage med færre end 100 smittede. De sorte kontinuerlige kurver repræsenterer en lovlovsregress
- Hvad er jetstrømmen, og hvordan påvirker klimaændringer den?
- Bro mellem kvantemekanik og generel relativitet er stadig mulig
- Muon -stråleanalyse af organisk stof i prøver fra rummet
- Europa gør klar til rekordstor hedebølge
- Hvordan ruster saltvand metaller?
- Syntetiseret mikroporøst 3D-grafenlignende carbonatomer


