Hvordan kom Erwin Schrodinger med sin atomteori?
Sådan udviklede Schrödinger sin ligning:
1.. bygger på eksisterende ideer: Schrödinger var opmærksom på begrænsningerne i Bohrs atommodel, som kun kunne forklare brintens opførsel. Han kendte også til bølgepartikeldualiteten af lys, foreslået af De Broglie, som antydede, at partikler også kunne udvise bølglignende egenskaber.
2. Bølgeforligningen: Han hentede inspiration fra disse koncepter og forsøgte at udvikle en matematisk beskrivelse af et elektron i et atom som en bølge. Han tilpassede bølgeforligningen fra klassisk fysik til at beskrive bølgefunktionen af et elektron. Denne bølgefunktion indeholder oplysninger om sandsynligheden for at finde elektronet på et givet sted og tidspunkt.
3. Schrödinger -ligningen: Den resulterende ligning, kendt som Schrödinger -ligningen, er et komplekst matematisk udtryk, der styrer bølgefunktionens opførsel. Den beskriver, hvordan bølgefunktionen af en elektron ændres over tid under påvirkning af atomkernen og andre kræfter.
4. Løsning af ligningen: Løsning af Schrödinger -ligningen for et givet atom giver et sæt løsninger kaldet bølgefunktioner. Hver bølgefunktion svarer til et specifikt energiniveau og orbitalform for et elektron i atomet. Disse opløsninger giver grundlaget for at forstå den elektroniske struktur af atomer og molekyler.
Nøglepunkter:
* Schrödinger -ligningen beskriver ikke atomet som et miniature solsystem med elektroner, der kredser om kernen som planeter. I stedet beskriver den elektronerne som sandsynlighedsbølger, spredt ud i rummet omkring kernen.
* Schrödinger -ligningen revolutionerede vores forståelse af atomet og lagde grundlaget for moderne kvantekemi og vores evne til at forudsige og forstå egenskaberne for atomer og molekyler.
Afslutningsvis foreslog Schrödinger ikke en ny atomteori i traditionel forstand. Han udviklede en matematisk ramme - Schrödinger -ligningen - der giver os mulighed for nøjagtigt at beskrive elektronernes opførsel i atomer og molekyler. Denne ligning markerede et paradigmeskifte i vores forståelse af atomet, bevæger sig væk fra klassisk fysik og ind i kvantemekanikens område.
 Varme artikler
Varme artikler
-
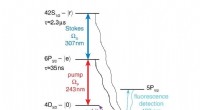 Fysikere viser muligheden for at bygge en fanget Rydberg ion kvantecomputerVed hjælp af lasere, forskerne exciterede en strontiumion til Rydberg-staten, som de derefter brugte til at demonstrere en enkelt-qubit Rydberg-port - et af de grundlæggende elementer i den foreslåede
Fysikere viser muligheden for at bygge en fanget Rydberg ion kvantecomputerVed hjælp af lasere, forskerne exciterede en strontiumion til Rydberg-staten, som de derefter brugte til at demonstrere en enkelt-qubit Rydberg-port - et af de grundlæggende elementer i den foreslåede -
 Vidne til fødslen af babyuniverser 46 gange:Sammenhængen mellem tyngdekraften og solitonKredit:CC0 Public Domain Forskere har forsøgt at finde på en ligning for at forene mikro- og makrolove i universet; kvantemekanik og tyngdekraft. Vi er et skridt nærmere med et papir, der viser, a
Vidne til fødslen af babyuniverser 46 gange:Sammenhængen mellem tyngdekraften og solitonKredit:CC0 Public Domain Forskere har forsøgt at finde på en ligning for at forene mikro- og makrolove i universet; kvantemekanik og tyngdekraft. Vi er et skridt nærmere med et papir, der viser, a -
 Atomisk trojansk hest kunne inspirere den nye generation af røntgenlasere og partikelkollidererIllustration, baseret på simuleringer, af den trojanske hesteteknik til fremstilling af elektroner med høj energi. En laserstråle (rød, til venstre) fjerner elektroner (blå prikker) af heliumatomer. N
Atomisk trojansk hest kunne inspirere den nye generation af røntgenlasere og partikelkollidererIllustration, baseret på simuleringer, af den trojanske hesteteknik til fremstilling af elektroner med høj energi. En laserstråle (rød, til venstre) fjerner elektroner (blå prikker) af heliumatomer. N -
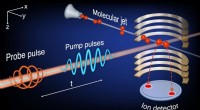 Den eksperimentelle observation af ekkoer i et enkelt molekyleKredit:Qiang et al. Ekkoer, lyde, der gentages eller giver genlyd som følge af bølger, der reflekteres tilbage til lytteren, forekomme i flere fysiske systemer. I fysikforskning, ekkoer bruges typ
Den eksperimentelle observation af ekkoer i et enkelt molekyleKredit:Qiang et al. Ekkoer, lyde, der gentages eller giver genlyd som følge af bølger, der reflekteres tilbage til lytteren, forekomme i flere fysiske systemer. I fysikforskning, ekkoer bruges typ
- De seneste storme giver det tørketrætte Californien grund til håb, men vil de fortsætte?
- Boeing rapporterer ingen nye jet-ordrer i januar
- Kan et flydende væskelignende materiale opretholde sin strukturelle orden som krystaller?
- Giv dig et eksempel på en øhav i Latinamerika?
- Kapløbet om at redde Myanmars Inle Lake
- Forskere skaber selvbærende, intelligent, elektroniske mikrosystemer fra grønt materiale


