Hvorfor er usikkerhedsprincippet og bølgekarakteren af partikler ikke signifikant, når man beskriver opførsel makroskopiske genstande, men betydelige elektroner?
1. Usikkerhedsprincip:
* Elektroner: Elektroner er små og lette. Usikkerhedsprincippet siger, at vi ikke kan kende både positionen og momentumet for en partikel med perfekt nøjagtighed. Jo mindre partiklen er, jo mere markant bliver denne usikkerhed. For elektroner er usikkerheden i deres position betydelig, hvilket gør det vanskeligt at spore deres nøjagtige vej.
* makroskopiske objekter: Makroskopiske genstande har meget større masser. Usikkerheden i deres position og momentum er ubetydelig sammenlignet med deres samlede størrelse og momentum. Dette betyder, at vi nøjagtigt kan beskrive deres bevægelse ved hjælp af klassisk mekanik.
2. Partiklernes bølge karakter:
* Elektroner: Elektroner udviser bølelignende opførsel, som demonstreres i eksperimenter som det dobbeltslitede eksperiment. Deres bølgelængde er sammenlignelig med størrelsen på atomer, hvilket fører til interferensmønstre. Denne bølgekarakter er afgørende for at forstå elektronadfærd i atomer og molekyler.
* makroskopiske objekter: Makroskopiske genstande har bølgelængder, der er alt for små til at være observerbare. Deres bølgelignende natur er fuldstændigt domineret af deres partikellignende opførsel, så vi kan behandle dem som klassiske genstande.
Kortfattet:
* Partiklernes usikkerhedsprincip og bølge er betydelig for elektroner på grund af deres lille størrelse og lave masse.
* Disse kvanteeffekter er ubetydelige for makroskopiske genstande på grund af deres meget større størrelse og masse.
Analogi:
Tænk på det sådan:Forestil dig at prøve at spore en lille kugleleje, der ruller over et stort bord. Det er vanskeligt at forudsige dens nøjagtige vej på grund af små tilfældige bevægelser. Forestil dig nu at prøve at spore en bowlingkugle, der ruller over den samme bord. Dets sti er meget lettere at forudsige, fordi dens størrelse og masse gør tilfældige bevægelser ubetydelige.
Dette svarer til, hvordan elektroner, der er små og lette, udviser betydelig kvanteadfærd, mens makroskopiske genstande, der er meget større og tungere, ikke.
 Varme artikler
Varme artikler
-
 Forskere opdager nye atomisk lag, tynd magnetIllustration af Kerr -effekt, der bruges til at detektere magnetisering gennem rotation af polariseret lys, når det interagerer med elektronspins i et materiale. Der vises lag af chrom germanium tellu
Forskere opdager nye atomisk lag, tynd magnetIllustration af Kerr -effekt, der bruges til at detektere magnetisering gennem rotation af polariseret lys, når det interagerer med elektronspins i et materiale. Der vises lag af chrom germanium tellu -
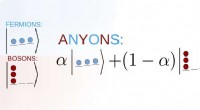 Ny tilgang til eksotisk kvantestofNår energiniveauerne i et kvantesystem er fyldt, fermioniske partikler udelukker hinanden, hvorimod bosonisk stof kan ophobes på det laveste niveau. I modsætning, nogen opfører sig på en mellemliggend
Ny tilgang til eksotisk kvantestofNår energiniveauerne i et kvantesystem er fyldt, fermioniske partikler udelukker hinanden, hvorimod bosonisk stof kan ophobes på det laveste niveau. I modsætning, nogen opfører sig på en mellemliggend -
 Forskere 3D-print roterende mikrofilter til laboratorie-på-en-chip-applikationerForskere fremstillede bittesmå magnetisk drevne roterende filtre til brug i mikrofluidkanaler. Filtrene er kun 70 mikrometer brede og 60 mikrometer høje med firkantede åbninger, der måler 6,5 mikromet
Forskere 3D-print roterende mikrofilter til laboratorie-på-en-chip-applikationerForskere fremstillede bittesmå magnetisk drevne roterende filtre til brug i mikrofluidkanaler. Filtrene er kun 70 mikrometer brede og 60 mikrometer høje med firkantede åbninger, der måler 6,5 mikromet -
 Forskning beskriver langsomt og hurtigt lys i plasmaLLNL Jupiter Laser Facility blev brugt til at opnå langsomt og hurtigt lys inde i plasmaer, demonstrerer derfor evnen til at skræddersy brydningsindekset for et laserplasmasystem. Kredit:Lawrence Live
Forskning beskriver langsomt og hurtigt lys i plasmaLLNL Jupiter Laser Facility blev brugt til at opnå langsomt og hurtigt lys inde i plasmaer, demonstrerer derfor evnen til at skræddersy brydningsindekset for et laserplasmasystem. Kredit:Lawrence Live
- III-V halvleder fotoniske integrerede kredsløb går kvante
- Ulemperne ved et Potentiometer
- hvordan en 1, 000 år gammel tsunami i Det Indiske Ocean peger på større risiko end oprindeligt an…
- Pyridin involveret i massedødelighed hos krebsdyr
- Havopvarmning har fiskeri på farten, hjælper nogle, men gør mere ondt
- Hvad får durian-frugten til at stinke? Kræftforskere knækker durian-genomet


