Hvordan kan vurderede konstant bestemmes ud fra loven?
Forståelse af hastighedslove
* rate lov: En hastighedslov udtrykker forholdet mellem reaktionshastigheden og koncentrationerne af reaktanterne. Det har den generelle form:
Hastighed =k [a]^m [b]^n
* sats: Ændringen i koncentration af en reaktant eller et produkt over tid.
* k: Hastighedskonstanten, en proportionalitetskonstant, der er specifik for reaktionen ved en given temperatur.
* [a], [b]: Koncentrationer af reaktanter.
* m, n: Reaktionsordrer, der er eksperimentelt bestemt eksponenter, der viser, hvordan hastigheden ændres med hensyn til koncentrationen af hver reaktant.
Metoder til at bestemme hastighedskonstanten (k)
1. Metode til indledende satser:
* eksperimentelt: Foretag flere eksperimenter med forskellige indledende koncentrationer af reaktanter.
* Mål den oprindelige sats: Bestem reaktionshastigheden helt i begyndelsen (når tiden =0).
* Analyser dataene:
* Hvis du fordobler koncentrationen af en reaktant og den indledende hastighed fordobles, er rækkefølgen med hensyn til denne reaktant 1.
* Hvis du fordobler koncentrationen af en reaktant og de indledende hastighedskobler, er rækkefølgen med hensyn til denne reaktant 2.
* Hvis den oprindelige hastighed ikke ændrer sig, når du ændrer koncentrationen af en reaktant, er rækkefølgen med hensyn til denne reaktant 0.
* Sæt værdierne i satsens lov: Når du kender reaktionsordrerne (m, n), skal du bruge hastighedsloven og dataene fra en af dine eksperimenter til at løse for 'k'.
2. Integreret sats lov:
* afledning: Den integrerede sats -lov er afledt af differentieret renten. Det vedrører koncentration til tiden.
* formularer: Den specifikke integrerede hastighedslov afhænger af reaktionens rækkefølge:
* Zeroth Order: [A] =-kt + [a] ₀
* første ordre: ln [a] =-kt + ln [a] ₀
* anden ordre: 1/[a] =kt + 1/[a] ₀
* eksperimentelt: Mål koncentrationen af en reaktant over tid.
* Plot dataene: Plot den passende funktion af koncentration (f.eks. Ln [a] for første orden) versus tid. Linjens hældning vil være lig med -k (eller k afhængigt af ligningens form).
Vigtige noter:
* Temperaturafhængighed: Hastighedskonstanten er meget afhængig af temperaturen. Arrhenius-ligningen beskriver dette forhold:k =a * exp (-ea/rt), hvor a er den præ-eksponentielle faktor, ea er aktiveringsenergien, r er gaskonstanten, og t er temperatur i kelvin.
* enheder af k: Enhederne i hastighedskonstanten afhænger af den samlede rækkefølge af reaktionen. For eksempel har en første ordens rentekonstant enheder af S⁻¹.
Eksempel:
Lad os sige, at hastighedsloven for en reaktion er:rate =k [a] [b] ²
For at finde 'k', skulle du:
1.. Bestem rækkefølgen af reaktionen: Foretag eksperimenter med forskellige koncentrationer af A og B og måle de indledende hastigheder. Dette giver dig værdierne for M og N.
2. Vælg et eksperiment: Vælg et eksperiment, hvor du kender de indledende koncentrationer af A og B, og den oprindelige hastighed.
3. Sæt værdierne i satsen: Udskift værdierne i ligningen:hastighed =k [a] [b] ² og løs for 'k'.
Fortæl mig, hvis du gerne vil have et mere specifikt eksempel eller vil arbejde gennem et bestemt problem!
 Varme artikler
Varme artikler
-
 Detektion af gravitationsbølgelinser kunne være et stykke vej vækKredit:Pixabay/CC0 Public Domain Gravitationsbølgeforskere leder efter beviser for linser, hvor de svageste gravitationsbølgesignaler bliver forstærket, Det er usandsynligt, at de vil foretage dis
Detektion af gravitationsbølgelinser kunne være et stykke vej vækKredit:Pixabay/CC0 Public Domain Gravitationsbølgeforskere leder efter beviser for linser, hvor de svageste gravitationsbølgesignaler bliver forstærket, Det er usandsynligt, at de vil foretage dis -
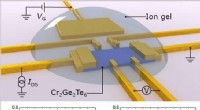 En elektrisk kontakt til magnetisme(Top) Skematisk felteffekttransistor baseret på ultratynd ferromagnetisk halvleder Cr2Ge2Te6. Materialet er dækket med en iongel for at forstærke felteffekten. (Bund) Magneto-modstand (MR) med stigend
En elektrisk kontakt til magnetisme(Top) Skematisk felteffekttransistor baseret på ultratynd ferromagnetisk halvleder Cr2Ge2Te6. Materialet er dækket med en iongel for at forstærke felteffekten. (Bund) Magneto-modstand (MR) med stigend -
 Optisk innovation kunne dæmpe rysten fra højeffektlasereBerkeley Lab doktorand Fumika Isono (i midten), BELLA Center vicedirektør Jeroen van Tilborg (th.), og forsker Sam Barber oprettede et nyt laserstabiliseringseksperiment på en af BELLA Centerets 100
Optisk innovation kunne dæmpe rysten fra højeffektlasereBerkeley Lab doktorand Fumika Isono (i midten), BELLA Center vicedirektør Jeroen van Tilborg (th.), og forsker Sam Barber oprettede et nyt laserstabiliseringseksperiment på en af BELLA Centerets 100 -
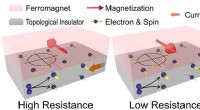 Forskere demonstrerer eksistensen af en ny form for magnetoresistens, der involverer topologiske i…Den skematiske figur illustrerer konceptet og adfærden ved magnetoresistens. Spins genereres i topologiske isolatorer. Dem i grænsefladen mellem ferromagnet og topologiske isolatorer interagerer med f
Forskere demonstrerer eksistensen af en ny form for magnetoresistens, der involverer topologiske i…Den skematiske figur illustrerer konceptet og adfærden ved magnetoresistens. Spins genereres i topologiske isolatorer. Dem i grænsefladen mellem ferromagnet og topologiske isolatorer interagerer med f
- Sådan neutraliseres muriatsyre
- Har et objekt, der bevæger sig i en lineær bane med acceleration i retning modsat bevægelse, fald…
- Hvad vi indtil videre ved om vulkanudbruddet i Island
- Hvad var Apollos ansvar?
- Hvilke processer i vandcyklussen får skyer til at dannes?
- Hvad er triglyceridernes monomerer?


