Hvilken eksperimentel egenskab korrelerer direkte med styrken af intermolekylære kræfter?
Her er hvorfor:
* Intermolekylære kræfter holder molekyler sammen. Stærkere intermolekylære kræfter kræver mere energi til at overvinde, hvilket betyder, at der er behov for mere energi for at bryde molekylerne fra hinanden og overføre dem fra en væske til en gas (kogning).
* kogepunkt er den temperatur, hvorpå et stof skifter fra en væske til en gas. Et højere kogepunkt indikerer stærkere intermolekylære kræfter, da der er behov for mere energi for at overvinde de attraktive kræfter og få molekylerne til at flygte ind i gasfasen.
For eksempel:
* vand (H₂O) har et højere kogepunkt end metan (ch₄). Dette skyldes, at vandmolekyler danner stærke brintbindinger, mens metan kun udviser svagere London -spredningskræfter.
Andre relaterede egenskaber:
Mens kogepunkt er den mest direkte korrelation, kan andre egenskaber bruges til at udlede styrken af intermolekylære kræfter:
* Viskositet: Væsker med stærke intermolekylære kræfter er mere viskøse (modstandsdygtige over for flow).
* overfladespænding: Stærkere intermolekylære kræfter fører til højere overfladespænding.
* damptryk: Stoffer med svagere intermolekylære kræfter har højere damptryk (de fordamper lettere).
Husk dog, at disse andre egenskaber er påvirket af faktorer udover intermolekylære kræfter, hvilket gør dem mindre direkte indikatorer.
 Varme artikler
Varme artikler
-
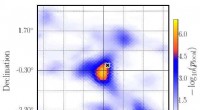 Ny søgning i hele himlen afslører potentielle neutrino-kilderPre-trial sandsynligheden for, at det observerede signal skyldes baggrund i et 5x5 graders vindue omkring det mest betydningsfulde punkt på den nordlige halvkugle (det hotteste sted); det sorte kryds
Ny søgning i hele himlen afslører potentielle neutrino-kilderPre-trial sandsynligheden for, at det observerede signal skyldes baggrund i et 5x5 graders vindue omkring det mest betydningsfulde punkt på den nordlige halvkugle (det hotteste sted); det sorte kryds -
 Ny kvantemodtager den første til at registrere hele radiofrekvensspektretEn Rydberg-modtager og spektrumanalysator registrerer en bred vifte af virkelige radiofrekvenssignaler over et mikrobølge-kredsløb inklusive AM-radio, FM -radio, Wi-Fi og Bluetooth. Kredit:illustratio
Ny kvantemodtager den første til at registrere hele radiofrekvensspektretEn Rydberg-modtager og spektrumanalysator registrerer en bred vifte af virkelige radiofrekvenssignaler over et mikrobølge-kredsløb inklusive AM-radio, FM -radio, Wi-Fi og Bluetooth. Kredit:illustratio -
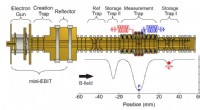 Højere præcisionsmålinger viser protonmasse mindre end antagetSkitse af opsætningen af fælden. Fældetårnet indeholder to separate opbevaringsfælder (ST-I, ST-II), målefælden (MT) og en referencefælde (RT) til magnetfeltovervågning, som i øjeblikket ikke bruges
Højere præcisionsmålinger viser protonmasse mindre end antagetSkitse af opsætningen af fælden. Fældetårnet indeholder to separate opbevaringsfælder (ST-I, ST-II), målefælden (MT) og en referencefælde (RT) til magnetfeltovervågning, som i øjeblikket ikke bruges -
 Remora-inspireret sugeskive efterligner fiskens vedhæftningsevne, giver evolutionær indsigtKredit:New Jersey Institute of Technology Remora -fisk er berømte blaffere i havverdenen, besidder kraftige sugediske på bagsiden af hovedet til at fastgøre sig på torpedo-lignende måde til stør
Remora-inspireret sugeskive efterligner fiskens vedhæftningsevne, giver evolutionær indsigtKredit:New Jersey Institute of Technology Remora -fisk er berømte blaffere i havverdenen, besidder kraftige sugediske på bagsiden af hovedet til at fastgøre sig på torpedo-lignende måde til stør
- Er det muligt at differentiere acceleration med hensyn til tid, hvis ja, hvad er udledningen?
- Interaktioner inden for kvantebatterier er nøglen til deres opladningsfordel
- Forskere rapporterer hæmning af cellulær aldring
- Eksperiment på vej til rumstation skruer ned for varmen
- Hundehunde designet af Ford blokerer fyrværkeri, tordenstøj
- Trump underskriver Space Force-direktivet


