Hvem opdagede, at elektroner bevæger sig i tomt rum et atom?
* J.J. Thomson (1897): Han opdagede elektronet og foreslog "blomme budding -modellen", hvor elektroner var indlejret i en positivt ladet sfære. Denne model statlige elektroner ikke eksplicit flyttede i tomt rum, men den antydede, at de ikke var fastgjort på et specifikt sted.
* Ernest Rutherford (1911): Udførte det berømte guldfolieeksperiment, hvilket beviste, at atomer har en lille, tæt, positivt ladet kerne i deres centrum. Denne opdagelse væltede blommepudding -modellen og førte til ideen om et for det meste tomt atom med en kerne omgivet af elektroner.
* Niels Bohr (1913): Foreslog BOHR -modellen, som antydede, at elektroner kredivt kernen i specifikke energiniveauer. Mens BoHR -modellen senere blev erstattet, var den den første til at introducere konceptet med elektroner, der bevægede sig i kvantiserede kredsløb omkring kernen.
* kvantemekanik (begyndelsen af det 20. århundrede): Denne banebrydende teori ændrede grundlæggende vores forståelse af atomer. Kvantemekanik viste, at elektroner ikke bevæger sig i kredsløb som planeter, men snarere findes som sandsynlighedsskyer kaldet orbitaler. Dette betyder, at selvom vi ikke kan finde den nøjagtige placering af et elektron på et givet tidspunkt, kan vi beregne sandsynligheden for at finde det i en bestemt region omkring kernen.
Selvom Rutherfords guldfolieeksperiment leverede det mest direkte bevis for den for det meste tomme struktur af et atom, var det udviklingen af kvantemekanik, der i sidste ende størknet tanken om, at elektroner bevæger sig i tomt rum inden for atomet, omend på en sandsynlig måde.
 Varme artikler
Varme artikler
-
 Hvordan NQISRC'erne udnytter kvanterevolutionenKredit:CC0 Public Domain Mens de har deres egne unikke områder af ekspertise og ressourcer, er NQISRCerne alle tilpasset den samme mission - fremme af kvanteinformationsvidenskab. Fem nationale kv
Hvordan NQISRC'erne udnytter kvanterevolutionenKredit:CC0 Public Domain Mens de har deres egne unikke områder af ekspertise og ressourcer, er NQISRCerne alle tilpasset den samme mission - fremme af kvanteinformationsvidenskab. Fem nationale kv -
 Astronomer slår kosmisk guld, bekræfte oprindelsen af ædle metaller i neutronstjernefusionerDen første påvisning af gravitationsbølger fra den katastrofale fusion af to neutronstjerner, og observation af synligt lys i kølvandet på denne fusion, endelig besvare et mangeårigt spørgsmål i astro
Astronomer slår kosmisk guld, bekræfte oprindelsen af ædle metaller i neutronstjernefusionerDen første påvisning af gravitationsbølger fra den katastrofale fusion af to neutronstjerner, og observation af synligt lys i kølvandet på denne fusion, endelig besvare et mangeårigt spørgsmål i astro -
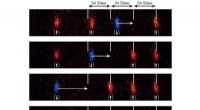 Sorteringsmaskine til atomerDe blå atomers spin adskiller sig fra de røde atomers spin. Laserstrålen vist med rødt holder således kun de røde atomer, mens de blå kan transporteres af den forskelligt polariserede laserstråle til
Sorteringsmaskine til atomerDe blå atomers spin adskiller sig fra de røde atomers spin. Laserstrålen vist med rødt holder således kun de røde atomer, mens de blå kan transporteres af den forskelligt polariserede laserstråle til -
 Forskere finder en måde at fange mystisk mørk verdenspartikel ved Large Hadron ColliderEt nyt papir skitserer en metode til direkte at detektere partikler fra den mørke verden ved hjælp af Large Hadron Collider. Indtil nu har vi kun været i stand til at foretage indirekte målinger og si
Forskere finder en måde at fange mystisk mørk verdenspartikel ved Large Hadron ColliderEt nyt papir skitserer en metode til direkte at detektere partikler fra den mørke verden ved hjælp af Large Hadron Collider. Indtil nu har vi kun været i stand til at foretage indirekte målinger og si
- Undersøgelse finder ud af, at Vesten er bedst til at spotte UFO'er
- Beviser viser øget risiko for ozontab over USA om sommeren
- Hvad er en plan helt præcist?
- Hvad ville der ske, hvis de fleste biokemiske reaktioner katalyseres af det samme enzym?
- Computersimuleringer viser, hvordan sorte huller med mellemmasse kan dannes inde i stjernehobe
- Er afbrænding af alkohol som brændstof en meget effektiv proces?


