Hvad fortæller temperatur os om partikler af stof?
Her er en sammenbrud:
* kinetisk energi er bevægelsesenergien. Jo hurtigere partiklerne bevæger sig, jo mere kinetisk energi har de.
* Temperatur er et mål for den gennemsnitlige kinetiske energi af partiklerne i et stof.
* Højere temperatur Betyder, at partiklerne bevæger sig hurtigere og har i gennemsnit mere kinetisk energi.
* lavere temperatur Betyder, at partiklerne bevæger sig langsommere og har i gennemsnit mindre kinetisk energi.
Her er, hvordan dette relaterer til materiens tilstande:
* faste stoffer: Partikler i faste stoffer er tæt pakket og vibrerer på plads. De har lav kinetisk energi, så temperaturen er lav.
* væsker: Partikler i væsker er mere spredt end faste stoffer og kan bevæge sig mere frit. De har højere kinetisk energi end faste stoffer, så temperaturen er højere.
* Gasser: Partikler i gasser er meget spredt og bevæger sig meget hurtigt rundt. De har den højeste kinetiske energi, så temperaturen er den højeste.
Vigtig note: Temperaturen er et gennemsnit. Selv i et stof ved en konstant temperatur vil individuelle partikler have forskellige kinetiske energier.
 Varme artikler
Varme artikler
-
 Små kredsløb, lange afstande:Mindre lysbehandlingsenheder til fiberoptisk kommunikationKredit:CC0 Public Domain Forskere ved Michigan Tech har kortlagt en støjreducerende magneto-optisk respons, der forekommer i fiberoptisk kommunikation, åbner døren for nye materialeteknologier. O
Små kredsløb, lange afstande:Mindre lysbehandlingsenheder til fiberoptisk kommunikationKredit:CC0 Public Domain Forskere ved Michigan Tech har kortlagt en støjreducerende magneto-optisk respons, der forekommer i fiberoptisk kommunikation, åbner døren for nye materialeteknologier. O -
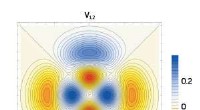 En teoretisk model vil tillade systematisk undersøgelse af en lovende klasse af særegne kvantetils…En universel teoretisk ramme vil hjælpe med at guide forskning om eksotiske topologiske tilstande, vist her med hensyn til den rumlige fordeling af elektrontilstande, som kunne bruges til at realisere
En teoretisk model vil tillade systematisk undersøgelse af en lovende klasse af særegne kvantetils…En universel teoretisk ramme vil hjælpe med at guide forskning om eksotiske topologiske tilstande, vist her med hensyn til den rumlige fordeling af elektrontilstande, som kunne bruges til at realisere -
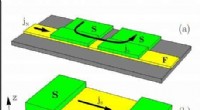 Bevægelige domænevægge inducerer tab i superleder/ferromagnet hybridsystemerJosephson Junction. Kredit:Universitetet i Jyväskylä/ Mihail Silaev Fysikere har vist, at bevægelsen af domænevægge kan detekteres ved at overvåge spænding genereret i superledende enheder. Denn
Bevægelige domænevægge inducerer tab i superleder/ferromagnet hybridsystemerJosephson Junction. Kredit:Universitetet i Jyväskylä/ Mihail Silaev Fysikere har vist, at bevægelsen af domænevægge kan detekteres ved at overvåge spænding genereret i superledende enheder. Denn -
 Når plasmoner når atomare fladlandSnapshot af en beregning, der viser en langsomt bevægende plasmonbølgepakke exciteret på monolag TaS2. Plasmonbølgepakken er meget lokaliseret i det virkelige rum selv ved ~1 ps efter dens oprettelse
Når plasmoner når atomare fladlandSnapshot af en beregning, der viser en langsomt bevægende plasmonbølgepakke exciteret på monolag TaS2. Plasmonbølgepakken er meget lokaliseret i det virkelige rum selv ved ~1 ps efter dens oprettelse
- Grønlands indlandsis smelter fra søkortene sammenlignet med de seneste fire århundreder
- Sådan finder du det mest bæredygtige og holdbare børnelegetøj
- Episk tørke betyder vandkrise på grænsen mellem Oregon og Californien
- Hvad er regionen Hertzsprung-Russel-diagram med flest stjerner?
- Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdom
- Hvad er Baader-Meinhof-fænomenet?


