En ballon indeholder en gas med tryk på 580 mm Hg og temperatur 227 grader C Hvad er det nye, når falder til 27 C?
forståelse af den kombinerede gaslov
Den kombinerede gaslov vedrører tryk (P), volumen (V) og temperatur (T) på en gas:
(P₁v₁)/t₁ =(p₂v₂)/t₂
Hvor:
* P₁ og V₁ er det oprindelige tryk og volumen
* T₁ er den oprindelige temperatur i Kelvin (K)
* P₂ og V₂ er det endelige pres og volumen
* T₂ er den endelige temperatur i Kelvin (K)
Løsning af problemet
1. Konverter temperaturer til Kelvin:
* T₁ =227 ° C + 273,15 =500,15 K
* T₂ =27 ° C + 273,15 =300,15 K
2. Identificer de kendte:
* P₁ =580 mm Hg
* T₁ =500,15 K
* T₂ =300,15 K
3. Antag, at lydstyrken er konstant (ikke angivet i problemet). Dette betyder V₁ =V₂
4. erstatte de kendte værdier i den kombinerede gaslovligning:
(580 mm Hg * V₁) /500,15 K =(P₂ * V₁) /300,15 K
5. Forenkle ligningen ved at annullere v₁:
(580 mm Hg) /500,15 K =(P₂) /300,15 K
6. Løs for P₂:
P₂ =(580 mm Hg * 300,15 K) / 500,15 K
P₂ ≈ 348 mm Hg
Derfor er det nye tryk på gassen i ballonen, når temperaturen falder til 27 ° C, ca. 348 mm Hg.
 Varme artikler
Varme artikler
-
 Kvantecomputernes mysteriumKredit:Sabrina Maniscalco Vores computere, selv de hurtigste, synes ude af stand til at modstå behovene i den enorme mængde data, der produceres i vores teknologiske samfund. Derfor arbejder forsk
Kvantecomputernes mysteriumKredit:Sabrina Maniscalco Vores computere, selv de hurtigste, synes ude af stand til at modstå behovene i den enorme mængde data, der produceres i vores teknologiske samfund. Derfor arbejder forsk -
 Forskere annoncerer opdagelsen af en atomisk elektronisk simulatorOpladningskonfigurationer af to tæt placerede DBer. Kredit:arXiv:1709.10091 [cond-mat.mes-hall] Målretning af applikationer som neurale netværk til maskinlæring, en ny opdagelse fra University of
Forskere annoncerer opdagelsen af en atomisk elektronisk simulatorOpladningskonfigurationer af to tæt placerede DBer. Kredit:arXiv:1709.10091 [cond-mat.mes-hall] Målretning af applikationer som neurale netværk til maskinlæring, en ny opdagelse fra University of -
 Mysteriet om neutronens levetidFra venstre, ORNL personale Matthew Frost og Leah Broussard arbejder ved Magnetism Reflectometer ved Spallation Neutron Source, bruges til en søgning efter spejlneutroner. Kredit:Genevieve Martin /Oak
Mysteriet om neutronens levetidFra venstre, ORNL personale Matthew Frost og Leah Broussard arbejder ved Magnetism Reflectometer ved Spallation Neutron Source, bruges til en søgning efter spejlneutroner. Kredit:Genevieve Martin /Oak -
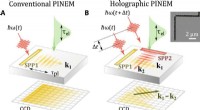 Holografisk billeddannelse af elektromagnetiske felter ved hjælp af elektronlys-kvanteinterferensKonventionel versus holografisk PINEM -billeddannelse. (A) I konventionel PINEM, udbredende SPPer er afbildet med lange elektronpulser, gengiver kun sin tidsmæssige konvolut med en rumlig opløsning Δx
Holografisk billeddannelse af elektromagnetiske felter ved hjælp af elektronlys-kvanteinterferensKonventionel versus holografisk PINEM -billeddannelse. (A) I konventionel PINEM, udbredende SPPer er afbildet med lange elektronpulser, gengiver kun sin tidsmæssige konvolut med en rumlig opløsning Δx
- Hvad er 6000954 i videnskabelig notation?
- Indsamling af heliumdiffraktionsmønstre i mikroskopiske områder af prøver
- Tesla minder om 14, 000 biler i Kina over Takata airbags
- Lav jord fremmer savanner i Sydamerika
- Ny metode vurderer blyfaren i jord
- Soliton-molekyler fik til at vibrere som rigtige molekyler


