Hvorfor har faste stoffer en bestemt form og volumen?
* Stærke interpartikelstyrker: Partiklerne i et fast stof er tæt pakket sammen og holdes tæt af stærke intermolekylære kræfter (som ioniske bindinger, kovalente bindinger eller metalliske bindinger). Disse kræfter begrænser partiklernes bevægelse og holder dem i et fast, stift arrangement.
* Begrænset partikelbevægelse: I modsætning til væsker eller gasser kan partiklerne i et fast stof kun vibrere omkring deres faste positioner. De kan ikke bevæge sig frit eller glide forbi hinanden. Denne begrænsede bevægelse opretholder solidens form.
* Høj densitet: Den tætte pakning af partikler i en solid resulterer i en høj densitet sammenlignet med væsker eller gasser. Denne densitet bidrager til solidens modstand mod komprimering og dets definerede volumen.
I modsætning hertil har væsker og gasser svagere interpartikelstyrker, hvilket giver deres partikler mulighed for at bevæge sig mere frit:
* væsker: Partikler i væsker kan bevæge sig og glide forbi hinanden, hvilket giver væsker et bestemt volumen, men giver dem mulighed for at tage formen på deres beholder.
* Gasser: Partikler i gasser har meget svage kræfter, der holder dem sammen. De bevæger sig frit og hurtigt, hvilket resulterer i ingen bestemt form eller volumen og let udvides til at fylde enhver beholder.
Sammenfattende er de stærke interpartikelstyrker og begrænset partikelbevægelse i faste stoffer ansvarlige for deres karakteristiske konkrete form og volumen.
 Varme artikler
Varme artikler
-
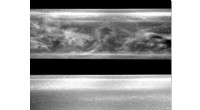 Ny tilgang kan spare op til 95 procent af den energi, der bruges til rørledningerTurbulent flow (øverst) sammenlignet med laminært flow (nederst). Kredit:Jakob Kühnen Forskere har antaget, at når en strøm af en væske er blevet turbulent, turbulensen ville fortsætte. Forskere v
Ny tilgang kan spare op til 95 procent af den energi, der bruges til rørledningerTurbulent flow (øverst) sammenlignet med laminært flow (nederst). Kredit:Jakob Kühnen Forskere har antaget, at når en strøm af en væske er blevet turbulent, turbulensen ville fortsætte. Forskere v -
 Kunstig intelligens fremskynder prognoser for at kontrollere fusionsforsøgFysiker Dan Boyer med figurer fra papir bag sig. Kredit:Amber Boyer / Kiran Sudarsanan Maskinelæring, en teknik, der bruges i kunstig intelligens (AI) -software bag selvkørende biler og digitale a
Kunstig intelligens fremskynder prognoser for at kontrollere fusionsforsøgFysiker Dan Boyer med figurer fra papir bag sig. Kredit:Amber Boyer / Kiran Sudarsanan Maskinelæring, en teknik, der bruges i kunstig intelligens (AI) -software bag selvkørende biler og digitale a -
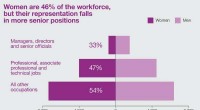 Kønsparitet:Ikke en forudgående konklusion på alle områderKvinder udgør cirka 47 procent af arbejdsstyrken, men er stadig underrepræsenteret på de højeste forretningsniveauer, regering, medicinske og akademiske hierarkier. Et team af forskere har udviklet en
Kønsparitet:Ikke en forudgående konklusion på alle områderKvinder udgør cirka 47 procent af arbejdsstyrken, men er stadig underrepræsenteret på de højeste forretningsniveauer, regering, medicinske og akademiske hierarkier. Et team af forskere har udviklet en -
 Kvanteteknologier kan anvendes på et standard telekommunikationsnetværkEt kvantekryptografienetværk integreret i kommercielt optisk netværk. Kredit:Åbn ClipArt -vektorer Spanske forskere har udviklet et kvantekryptografienetværk integreret i et kommercielt optisk net
Kvanteteknologier kan anvendes på et standard telekommunikationsnetværkEt kvantekryptografienetværk integreret i kommercielt optisk netværk. Kredit:Åbn ClipArt -vektorer Spanske forskere har udviklet et kvantekryptografienetværk integreret i et kommercielt optisk net
- Forskere undersøger, hvordan man gør PV endnu grønnere
- Ultratyndt, men sejt implanterbart materiale kan behandle rygmarvsskade og Parkinsons sygdom
- Video:Jupiters hemmeligheder
- Hvad er temperaturen 89.2degrees Celsius i Fahrenheit?
- Effekter af guldminedrift på miljøet
- Hvad forklarer Bryophyllum kort?


