Hvilke kræfter har typisk ikke -metale atomer inden for et molekyle?
Her er hvorfor:
* ikke -metaller har høj elektronegativitet: De har en stærk tendens til at tiltrække elektroner. Dette betyder, at de sandsynligvis deler elektroner med andre ikke -metale atomer i stedet for at miste eller få dem fuldstændigt (hvilket er karakteristisk for ionisk binding).
* kovalente obligationer involverer deling: I kovalente bindinger deler ikke -metale atomer elektroner for at opnå en stabil elektronkonfiguration og opfylder octetreglen. Denne deling skaber en stærk attraktion mellem atomerne og holder dem sammen i et molekyle.
Typer af kovalente obligationer:
* enkelt kovalent binding: Et par elektroner deles mellem to atomer.
* dobbelt kovalent obligation: To par elektroner deles.
* Triple Covalent Bond: Tre par elektroner deles.
Eksempler på molekyler indeholdt af kovalente bindinger:
* vand (H₂O): Oxygen deler to elektroner med hvert hydrogenatom.
* kuldioxid (co₂): Carbon deler to par elektroner med hvert iltatom.
* methan (ch₄): Carbon deler et par elektroner med hvert hydrogenatom.
Bemærk: Mens kovalente bindinger er den primære kraft, der holder ikke -metalatomer sammen i molekyler, er der andre svagere kræfter, der kan påvirke molekylære egenskaber, såsom:
* van der Waals Forces: Dette er midlertidige, svage attraktioner mellem molekyler på grund af midlertidige udsving i elektronfordeling.
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, hvor et hydrogenatom er bundet til et stærkt elektronegativt atom som ilt eller nitrogen.
Sidste artikelHvem teori om universet var en lov, selvom den var forkert?
Næste artikelHvad er Einsteinium lavet af?
 Varme artikler
Varme artikler
-
 Forbedret 3D-billeddannelse er klar til at fremme behandlinger for hjernesygdommeKredit:CC0 Public Domain Forskere har udviklet en kombination af kommercielt tilgængelig hardware og open source-software, kaldet PySight, hvilket forbedrer hurtig 2-D og 3-D billeddannelse af hje
Forbedret 3D-billeddannelse er klar til at fremme behandlinger for hjernesygdommeKredit:CC0 Public Domain Forskere har udviklet en kombination af kommercielt tilgængelig hardware og open source-software, kaldet PySight, hvilket forbedrer hurtig 2-D og 3-D billeddannelse af hje -
 Fysikere foreslår nye teorier om sorte huller fra det meget tidlige universTeorien om, at urets sorte huller kolliderer med neutronstjerner for at skabe tunge grundstoffer, forklarer manglen på neutronstjerner i midten af Mælkevejen, et mangeårigt mysterium. Kredit:Univers
Fysikere foreslår nye teorier om sorte huller fra det meget tidlige universTeorien om, at urets sorte huller kolliderer med neutronstjerner for at skabe tunge grundstoffer, forklarer manglen på neutronstjerner i midten af Mælkevejen, et mangeårigt mysterium. Kredit:Univers -
 Den første observation af en stabil torus af væskers resonansfrekvenserSet ovenfra af mønsteret observeret på den ydre periferi af en kviksølvring udsat for vibrationer. Antallet af lapper stiger med frekvensen af vibrationen (henholdsvis fra venstre mod højre, fra top
Den første observation af en stabil torus af væskers resonansfrekvenserSet ovenfra af mønsteret observeret på den ydre periferi af en kviksølvring udsat for vibrationer. Antallet af lapper stiger med frekvensen af vibrationen (henholdsvis fra venstre mod højre, fra top -
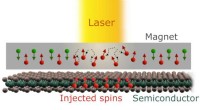 Mod ultrahurtig spintronicsSkematisk af spin-injektion eksperiment. Kredit:J. C. W. Song og Y. D. Chong Elektronik har avanceret gennem kontinuerlige forbedringer inden for mikroprocessorteknologi siden 1960erne. Imidlertid
Mod ultrahurtig spintronicsSkematisk af spin-injektion eksperiment. Kredit:J. C. W. Song og Y. D. Chong Elektronik har avanceret gennem kontinuerlige forbedringer inden for mikroprocessorteknologi siden 1960erne. Imidlertid


