Hvad er de to typer kræfter, der handler mellem atomer?
1. Intermolekylære kræfter: Dette er de kræfter, der holder molekyler sammen. De er svagere end intramolekylære kræfter og er ansvarlige for egenskaber som kogepunkt, smeltepunkt og viskositet. Der er flere typer intermolekylære kræfter, herunder:
* Hydrogenbinding: Dette er den stærkeste type intermolekylær kraft, der forekommer, når et brintatom er bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor.
* dipol-dipolinteraktioner: Disse forekommer mellem polære molekyler, der har et permanent dipolmoment.
* London Dispersion Forces: Dette er den svageste type intermolekylær kraft og forekommer mellem alle molekyler, endda ikke -polære. De stammer fra midlertidige udsving i elektrondensitet.
2. intramolekylære kræfter: Dette er de kræfter, der holder atomer sammen i et molekyle. De er meget stærkere end intermolekylære kræfter og er ansvarlige for de kemiske bindinger, der danner molekyler. Disse inkluderer:
* ioniske bindinger: Disse involverer den elektrostatiske tiltrækning mellem modsat ladede ioner.
* kovalente obligationer: Disse involverer deling af elektroner mellem atomer.
Så i det væsentlige er intermolekylære kræfter de "lim", der holder molekyler sammen, mens intramolekylære kræfter er "lim", der holder atomer sammen i et molekyle.
 Varme artikler
Varme artikler
-
 Søger efter manglende antistof:En vellykket start på målinger med Belle IIModel af Belle II-detektoren:Elektroner og deres antipartikler, positronerne, accelereres i SuperKEKB-ringen og støder sammen i Belle IIs kerne. Kredit:KEK/Belle II Siden 25. marts har 2019, Belle
Søger efter manglende antistof:En vellykket start på målinger med Belle IIModel af Belle II-detektoren:Elektroner og deres antipartikler, positronerne, accelereres i SuperKEKB-ringen og støder sammen i Belle IIs kerne. Kredit:KEK/Belle II Siden 25. marts har 2019, Belle -
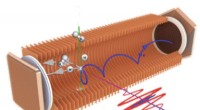 Når kerner indhenter elektronerI AttoCOLTRIMS -apparatet, den tredimensionelle bevægelse af elektroner (blå elliptiske pil) og ioner (H2+ og H+, grå pile) kan detekteres tilfældigt. Kombinationen af en ekstrem-ultraviolet (XUV, b
Når kerner indhenter elektronerI AttoCOLTRIMS -apparatet, den tredimensionelle bevægelse af elektroner (blå elliptiske pil) og ioner (H2+ og H+, grå pile) kan detekteres tilfældigt. Kombinationen af en ekstrem-ultraviolet (XUV, b -
 Forskere udvikler den næste generation af endoskopiteknologiEndoskopiobjektivet monteret på koblingsobjektivet. Kredit:FAU/Sebastian Schürmann Bioteknologer, fysikere, og medicinske forskere ved Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) har u
Forskere udvikler den næste generation af endoskopiteknologiEndoskopiobjektivet monteret på koblingsobjektivet. Kredit:FAU/Sebastian Schürmann Bioteknologer, fysikere, og medicinske forskere ved Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) har u -
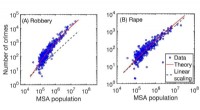 Større byer øger social kriminalitet(A) Antal røveristilfælde i forhold til befolkningen i det statistiske byområde. (B) Antal voldtægtssager i forhold til befolkningen i det statistiske byområde. Begge for USA i 2012. Røde solide kurve
Større byer øger social kriminalitet(A) Antal røveristilfælde i forhold til befolkningen i det statistiske byområde. (B) Antal voldtægtssager i forhold til befolkningen i det statistiske byområde. Begge for USA i 2012. Røde solide kurve
- Fair trade:Din sjæl for data?
- Indonesien kunne høste solenergi fra 10 milliarder paneler, men hvor placerer vi dem?
- Hvordan et atomangreb på Nordkorea ville bidrage til den globale kræftepidemi
- Stadier af en tropisk cyklon
- Kunne vi genbruge plastikposer til fremtidens stoffer?
- Somebodys watching you:Overvågning af selvkørende biler


