Hvad øges, når elektronegativitetsdiffferensen?
* ionisk karakter af bindingen: En større elektronegativitetsforskel betyder, at en atom har et stærkere træk på de delte elektroner, hvilket fører til en mere ulig deling og en større ionisk karakter.
* polaritet af obligationen: Jo større elektronegativitetsforskellen er, desto mere polariseret bliver bindingen. Dette betyder, at de delte elektroner trækkes tættere på det mere elektronegative atom, hvilket skaber delvis positive og negative ladninger (δ+ og Δ-) på atomerne.
* obligationsstyrke (i nogle tilfælde): Generelt er ioniske bindinger stærkere end kovalente bindinger. Efterhånden som elektronegativitetsforskellen stiger, kan bindingsstyrken også stige, især når man nærmer sig en fuld ionisk karakter. Der er dog undtagelser, og nogle kovalente bindinger med store forskelle i elektronegativitet kan være stærkere end nogle ioniske bindinger.
* dipolmoment: Dipolmomentet er et mål for polariteten af et molekyle. Større elektronegativitetsforskelle fører til større dipolmomenter.
Kortfattet:
En større elektronegativitetsforskel fører til en mere ionisk binding, stærkere polaritet og et større dipolmoment. Obligationsstyrken kan også stige, men dette er ikke altid tilfældet.
 Varme artikler
Varme artikler
-
 Generering af fotoner til kommunikation i et kvanteberegningssystemIndviklede par af fotoner genereres af og formerer sig væk fra qubits placeret langs en bølgeleder. Kredit:Sampson Wilcox MIT -forskere, der bruger superledende kvantebits forbundet til en mikrobø
Generering af fotoner til kommunikation i et kvanteberegningssystemIndviklede par af fotoner genereres af og formerer sig væk fra qubits placeret langs en bølgeleder. Kredit:Sampson Wilcox MIT -forskere, der bruger superledende kvantebits forbundet til en mikrobø -
 Forskere besvarer langvarige spørgsmål om relaxor ferroelektriDette viser den røntgenstråle diffuse spredning, der hjalp Argonne forskere og deres samarbejdspartnere med at begynde at besvare langvarige spørgsmål om relaxor ferroelektri, en teknologisk vigtig ma
Forskere besvarer langvarige spørgsmål om relaxor ferroelektriDette viser den røntgenstråle diffuse spredning, der hjalp Argonne forskere og deres samarbejdspartnere med at begynde at besvare langvarige spørgsmål om relaxor ferroelektri, en teknologisk vigtig ma -
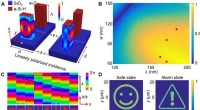 Holografiske metasurface-gassensorer til øjeblikkelige visuelle alarmerNumerisk optimering af asymmetrisk koblede metasurfaces. (A) Elementer af den foreslåede metasurface bestående af a-Si:H nanoantenner, der viser de elektriske og magnetiske feltintensitetsfordelinger
Holografiske metasurface-gassensorer til øjeblikkelige visuelle alarmerNumerisk optimering af asymmetrisk koblede metasurfaces. (A) Elementer af den foreslåede metasurface bestående af a-Si:H nanoantenner, der viser de elektriske og magnetiske feltintensitetsfordelinger -
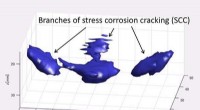 Piezoelektrisk og laser ultralydssystem tager 3-D ultralydsbilleder af faste stoffer3D-billeddannelse i høj opløsning resultat af forgrenet spændingskorrosion. Kredit:Yoshikazu Ohara, Tohoku Universitet Et nyt system, udviklet af Tohoku University-forskere i Japan i samarbejde me
Piezoelektrisk og laser ultralydssystem tager 3-D ultralydsbilleder af faste stoffer3D-billeddannelse i høj opløsning resultat af forgrenet spændingskorrosion. Kredit:Yoshikazu Ohara, Tohoku Universitet Et nyt system, udviklet af Tohoku University-forskere i Japan i samarbejde me
- Diamond og sod er meget forskellige, men begge naturlige former for?
- Hvad er testprincippet?
- NASA-missionen vil studere kosmos med en stratosfærisk ballon
- Hvad er molariteten af 4 mol NaOH opløst i 2 L vand?
- Hvilket lag af jordopbevaringsstedet for magma?
- Er den samlede vinkelhastighed af universet nul?


