Hvad ville der ske, hvis temperaturen på væsker blev reduceret i bevægelsesmolekyler?
* Temperatur og molekylær bevægelse: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekylerne i et stof. Jo højere temperatur, jo hurtigere bevæger molekylerne sig.
* væsker og molekylær bevægelse: I væsker har molekyler mere frihed til at bevæge sig end i faste stoffer, men de er stadig relativt tæt sammen. De vibrerer, roterer og oversætter (flyt fra sted til sted).
* Reduktion af temperatur: Når du reducerer temperaturen på en væske, reducerer du den gennemsnitlige kinetiske energi for dens molekyler. Dette forårsager:
* langsommere bevægelse: Molekyler bevæger sig langsommere, vibrerer mindre og kolliderer sjældnere.
* Nedsat afstand: De attraktive kræfter mellem molekyler bliver stærkere i forhold til den kinetiske energi, hvilket får molekylerne til at pakke tættere sammen.
* faseændring: Til sidst, når temperaturen fortsætter med at falde, når væsken sit frysepunkt. På dette tidspunkt er molekylerne bremset nok til at danne en mere ordnet struktur, der er karakteristisk for et fast stof.
Kortfattet: Reduktion af temperaturen på en flydende bremser bevægelsen af dens molekyler, hvilket får dem til at pakke tættere sammen og potentielt ændre tilstand til et fast stof.
Sidste artikelHvad repræsenterer massenummeret i helium?
Næste artikelHvilken atommasse er 35.453?
 Varme artikler
Varme artikler
-
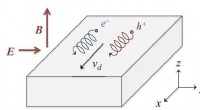 Nye materialer, opvarmet under høje magnetfelter, kunne producere rekordniveauer af energi, model v…Skematisk afbildning af E × B -driften af bærere i et stærkt magnetfelt. Elektroner (mærket e−) og huller (mærket h+) driver i samme retning under påvirkning af krydsede elektriske og magnetiske fel
Nye materialer, opvarmet under høje magnetfelter, kunne producere rekordniveauer af energi, model v…Skematisk afbildning af E × B -driften af bærere i et stærkt magnetfelt. Elektroner (mærket e−) og huller (mærket h+) driver i samme retning under påvirkning af krydsede elektriske og magnetiske fel -
 At bringe en skjult superledende tilstand frem i lysetFysikeren Genda Gu rummer en enkeltkrystal stang af LBCO-en forbindelse fremstillet af lanthan, barium, kobber, og ilt-i Brookhavens state-of-the-art krystalvækstlaboratorium. Den infrarøde billedovn,
At bringe en skjult superledende tilstand frem i lysetFysikeren Genda Gu rummer en enkeltkrystal stang af LBCO-en forbindelse fremstillet af lanthan, barium, kobber, og ilt-i Brookhavens state-of-the-art krystalvækstlaboratorium. Den infrarøde billedovn, -
 Varme elektroner høstet uden tricksEt opsætning til ultrahurtig spektroskopi, som brugt i undersøgelsen. Kredit:Maxim Pchenitchnikov, Universitetet i Groningen Halvledere konverterer energi fra fotoner (lys) til en elektronstrøm. I
Varme elektroner høstet uden tricksEt opsætning til ultrahurtig spektroskopi, som brugt i undersøgelsen. Kredit:Maxim Pchenitchnikov, Universitetet i Groningen Halvledere konverterer energi fra fotoner (lys) til en elektronstrøm. I -
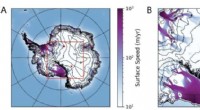 Undersøgelse giver en ny forklaring på neutrinoanomalier i AntarktisEt kort (venstre) og zoom-ind (højre) over Antarktis, viser de to unormale opadpegende hændelser - repræsenteret ved røde prikker - observeret af ANITA-eksperimentet, overlejret med overfladeishastigh
Undersøgelse giver en ny forklaring på neutrinoanomalier i AntarktisEt kort (venstre) og zoom-ind (højre) over Antarktis, viser de to unormale opadpegende hændelser - repræsenteret ved røde prikker - observeret af ANITA-eksperimentet, overlejret med overfladeishastigh
- Hvad er processen med at konvertere et stof fra dets flydende fase til gasformig fase?
- Hvad er en subtropisk storm, og hvordan adskiller den sig fra et tropisk eller ekstratropisk system?…
- Er brint den næst mest rigelige gas?
- NASAs satellitbilleder finder Fabio rasende hurtigt
- Hvad er æstetosfæren?
- Uranus:Planeten på en meget skrå akse


