Rejser elektroner så hurtigt, at det er umuligt at kende deres nøjagtige placering?
Det handler ikke om hastighed, det handler om usikkerhed.
Mens elektroner bevæger sig utroligt hurtigt inden for et atom, er deres "hastighed" ikke den primære grund til, at vi ikke kan kende deres nøjagtige placering. Det er et grundlæggende princip kaldet Heisenbergs usikkerhedsprincip .
Heisenbergs usikkerhedsprincip siger, at det er umuligt at kende både positionen og momentumet (som inkluderer hastighed) af en partikel med perfekt nøjagtighed. Jo mere præcist vi måler den ene, jo mindre præcist kan vi måle den anden.
Så hvordan vedrører dette elektroner?
* Elektroner er små: De er utroligt små, og deres opførsel styres af kvantemekanik.
* bølgepartikel dualitet: Elektroner udviser både bølge-lignende og partikellignende egenskaber. Dette betyder, at vi ikke kan tænke på dem som bare små kugler, der suser rundt.
* Sandsynlighedsskyer: Vi beskriver placeringen af et elektron i et atom ved hjælp af en sandsynlighedssky. Denne sky repræsenterer sandsynligheden for at finde elektronet på et givet punkt i rummet.
Kort sagt kan vi ikke kende en elektrons nøjagtige placering, fordi:
1. kvantemekanik: Reglerne for kvantemekanik styrer deres opførsel, ikke den klassiske fysik for hverdagens genstande.
2. Usikkerhed: Heisenbergs princip begrænser vores evne til at kende både position og momentum nøjagtigt.
3. sandsynlighed: Vi kan kun beskrive sandsynligheden for at finde en elektron i en bestemt region, ikke dets nøjagtige position.
Det er vigtigt at bemærke:
* Usikkerhedsprincippet betyder ikke, at vi ikke ved noget. Det betyder bare, at der er en grænse for, hvor netop vi kan kende både position og momentum.
* Elektronens hastighed spiller en rolle i, hvordan dens sandsynlighedssky er formet, men det er ikke den eneste bestemmende faktor.
Fortæl mig, hvis du gerne vil dykke dybere ned i nogen af disse koncepter!
 Varme artikler
Varme artikler
-
 Test af bølgefunktionskollaps tyder på, at tyngdekraften ikke er svaretDiósi – Penrose (DP) -modellen for tyngdekraftsrelateret bølgefunktionskollaps. en, Ifølge kvantegravitation, en rumlig kvanteoverlejring af et system (rød kugle) genererer en overlejring af forskelli
Test af bølgefunktionskollaps tyder på, at tyngdekraften ikke er svaretDiósi – Penrose (DP) -modellen for tyngdekraftsrelateret bølgefunktionskollaps. en, Ifølge kvantegravitation, en rumlig kvanteoverlejring af et system (rød kugle) genererer en overlejring af forskelli -
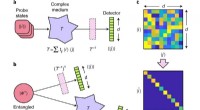 Viser sammenfiltring gennem et fiberkabel med høj kvalitetGrundlæggende princip. Kredit: Naturfysik (2020). DOI:10.1038/s41567-020-0970-1 Et team af forskere fra Heriot-Watt University, Indian Institute of Technology og University of Glasgow har demonst
Viser sammenfiltring gennem et fiberkabel med høj kvalitetGrundlæggende princip. Kredit: Naturfysik (2020). DOI:10.1038/s41567-020-0970-1 Et team af forskere fra Heriot-Watt University, Indian Institute of Technology og University of Glasgow har demonst -
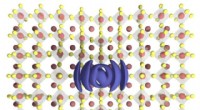 Undersøgelse af lovende fotovoltaisk materiale fører til opdagelse af en ny stoftilstandForvrængningen af perovskitkrystalgitteret efterfølges af dannelsen af et exciton-kvantedråbe. Kredit:Colin Sonnichsen Forskere ved McGill University har fået ny indsigt i, hvordan perovskitte
Undersøgelse af lovende fotovoltaisk materiale fører til opdagelse af en ny stoftilstandForvrængningen af perovskitkrystalgitteret efterfølges af dannelsen af et exciton-kvantedråbe. Kredit:Colin Sonnichsen Forskere ved McGill University har fået ny indsigt i, hvordan perovskitte -
 Kvantespring for masse, da videnskaben omdefinerer kilogrammetForskere kan nu måle, hvor meget kvanteenergi der er nødvendig for at fortrænge masse, gør deres beregninger for et kilo umådeligt mere præcise Forseglet i en hvælving under en hertuges tidligere
Kvantespring for masse, da videnskaben omdefinerer kilogrammetForskere kan nu måle, hvor meget kvanteenergi der er nødvendig for at fortrænge masse, gør deres beregninger for et kilo umådeligt mere præcise Forseglet i en hvælving under en hertuges tidligere
- Sådan læser du den periodiske tabel for Kids
- Hvad dannes udvaskningssletter som følge af aflejring?
- Intel modtager meddelelse om forskning i side-kanal sårbarhed
- København bedste, Rom værst for rent, sikre veje:undersøgelse
- Sådan kontrolleres alger ved hjælp af et spektrofotometer
- Unik grænseflade og uventet adfærd hjælper med at forklare, hvordan tungmetaller virker


